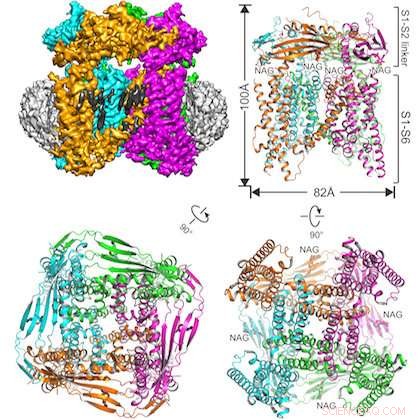
L'illustrazione mostra la proteina studiata incorporata in una struttura a nanodisco (in alto a sinistra) e tre viste del canale ionico TRPML1 da diverse angolazioni. Credito:UT Southwestern
I ricercatori dell'UT Southwestern Medical Center hanno pubblicato oggi una struttura atomica 3D del canale ionico trovata nei mammiferi che è implicata in un raro, malattie neurodegenerative ereditarie nell'uomo. Il lavoro segna la prima struttura di questo tipo determinata utilizzando la struttura di microscopia crioelettronica (crio-EM) dell'università da 17 milioni di dollari aperta l'anno scorso.
In crio-EM, i campioni vengono rapidamente congelati per prevenire la formazione di cristalli di ghiaccio dannosi e quindi visualizzati a meno 321 gradi Fahrenheit (temperature criogeniche). La struttura di UT Southwestern, aperta 24 ore su 24, è una delle migliori strutture al mondo per la biologia strutturale crio-EM.
Il team interdisciplinare ha risolto la struttura del canale ionico del topo TRPML1 (mucolipina potenziale del recettore transitorio 1).
Il loro studio, pubblicato online da Natura , arriva appena una settimana dopo che tre sviluppatori della tecnologia crio-EM sono stati premiati con il Premio Nobel per la Chimica 2017 per il loro lavoro sugli strumenti e sulle metodologie che hanno scatenato la "rivoluzione della risoluzione". Cryo-EM consente visualizzazioni a livello atomico di proteine che resistono alla cristallizzazione necessaria per la cristallografia a raggi X tradizionale.
"I canali ionici funzionanti sono necessari per il corretto movimento di particelle caricate elettricamente - ioni - dentro e fuori dalle cellule e dagli organelli per eseguire i processi cellulari, " ha detto il dottor Youxing Jiang, Professore di Fisiologia e Biofisica, un investigatore presso l'Howard Hughes Medical Institute (HHMI), e co-autore corrispondente dello studio.
Il canale TRPML1, che regola il flusso di ioni calcio, si trova in ogni mammifero. Il canale si trova nella membrana degli organelli all'interno di cellule chiamate lisosomi, che contengono enzimi che aiutano nel riciclaggio cellulare abbattendo grandi molecole.
Circa 50 malattie da accumulo lisosomiale (LSD) sono state identificate nell'uomo, inclusa una classe di LSD causate da mutazioni con perdita di funzione nei geni che governano i canali TRPML1. Questo LSD, chiamata mucolipidosi di tipo IV, è caratterizzato da uno sviluppo ritardato delle capacità mentali e motorie e da una disabilità visiva, secondo l'Istituto Superiore di Sanità.
"A causa del suo legame con quella classe di malattie da accumulo lisosomiale, TRPML1 è stato un potenziale bersaglio per terapie con piccole molecole e sono stati sviluppati diversi potenziali agonisti (apri di canale), " ha detto il dottor Jiang, un W.W. Carut, Jr. Scholar in ricerca biomedica. La determinazione della struttura di TRPML1 potrebbe aiutare nella ricerca di trattamenti per la mucolipidosi di tipo IV, Egli ha detto.
La struttura crio-EM di UT Southwestern ospita tre strumenti ad alta tecnologia, compreso un 12 piedi e mezzo di altezza, Titan Krios da 2 tonnellate che spara un raggio ad alta potenza attraverso ogni campione mentre una speciale fotocamera cattura le immagini degli elettroni dispersi che risultano. Un braccio robotico all'interno della macchina può contenere e spostare con precisione una dozzina di campioni congelati con flash in modo automatizzato in modo che possano essere registrate migliaia di immagini, elaborati tramite computer, e interpretato per generare immagini 3D per lo studio, hanno spiegato i ricercatori.

Il gruppo di ricerca UTSW che ha determinato la struttura atomica 3-D di un canale ionico include (riga in basso, da sinistra) Dott. Youxing Jiang e Xiaochen Bai, e (riga in alto, da sinistra) Jiangtao Guo, Quingfeng Chen, Weizhong Zeng, e Ji She. Credito:UT Southwestern
Un'altra distinzione in questo studio è l'uso riuscito di una tecnica di preparazione del campione relativamente nuova:incorporare la proteina di interesse in una struttura a nanodisco composta da lipidi e altri materiali biologici. L'autore principale Dr. Qingfeng Chen, un ricercatore post-dottorato nel laboratorio Jiang, creato il campione.
"Per molto tempo, detergente è stato utilizzato per estrarre le proteine dalle membrane per lo studio. La gente ha suggerito che il detersivo potrebbe cambiare la struttura proteica dal suo stato nativo, " ha detto il dottor Xiaochen Bai, un assistente professore di biofisica e biologia cellulare e il secondo autore corrispondente dello studio. "Proteine di membrana, come quelli che abbiamo studiato, sono generalmente avvolti da lipidi. I nanodischi vengono utilizzati per fornire un ambiente nativo per il campione di proteine".
Il dottor Bai è specializzato nel sofisticato software utilizzato per rivelare l'organizzazione dei singoli atomi all'interno di ogni particella. È stato reclutato all'UT Southwestern come borsista del Cancer Prevention and Research Institute of Texas (CPRIT) e come borsista della Virginia Murchison Linthicum in ricerca medica dopo cinque anni di formazione presso il MRC Laboratory of Molecular Biology di Cambridge, UK.
Lavorando su un team che sviluppa quello che è diventato uno dei migliori programmi software per l'elaborazione dei dati di immagine generati dalla microscopia elettronica, Il Dr. Bai ha avuto molte conversazioni con il Dr. Richard Henderson, uno dei tre scienziati ha assegnato il premio Nobel per la chimica la scorsa settimana.
"Ha trascorso giorno e notte in laboratorio lavorando allo sviluppo del metodo per la crio-EM. Uno dei suoi grandi contributi è stato lo sviluppo di un nuovo tipo di fotocamera per scattare foto migliori delle proteine studiate con la crio-EM, "Il dottor Bai ha detto. "Quando mi sono trasferito per la prima volta in Inghilterra, mi ha dato molta guida e supporto e abbiamo avuto molte discussioni sulle tecniche crio-EM".