Credito:Synthelis / Illusciencia
Il virus dell'epatite C (HCV) è un virus nato nel sangue che causa malattie del fegato e cancro, con più di 300, 000 persone muoiono ogni anno e 71 milioni di persone vivono con un'infezione cronica in tutto il mondo. Mentre i farmaci antivirali sono attualmente utilizzati, non è attualmente disponibile alcuna vaccinazione e gli effetti collaterali possono portare a una diagnosi errata.
Nella ricerca di nuove terapie per l'HCV, i ricercatori hanno guardato alla proteina di membrana p7, che svolge un ruolo chiave nel rilascio del virus, per le risposte. Però, ci sono pochi dati disponibili, e la struttura cristallografica della proteina non è stata ancora risolta.
Recenti indagini che utilizzano neutroni hanno portato allo sviluppo di un nuovo metodo per studiare l'integrazione e la struttura della proteina all'interno di un ambiente di membrana biologica nativa. Una collaborazione tra Synthelis SAS, Università Grenoble Alpes, e l'Istituto Laue-Langevin (ILL) hanno permesso ai ricercatori di osservare per la prima volta la struttura di un complesso proteico funzionale p7 dall'HCV all'interno di un doppio strato lipidico fisiologicamente rilevante, a risoluzione nanometrica.
Per fare questo, gli scienziati hanno eseguito la riflettometria neutronica (NR) su FIGARO, un riflettometro del tempo di volo presso il principale centro mondiale per la scienza dei neutroni, MALATO a Grenoble, Francia. Intervalli di trasferimento del momento di 0,008> qz> 0,2 Å-1 e riflettività minima di R ~ 5x10-7 sono stati misurati utilizzando lunghezze d'onda λ =2-20 , due angoli di incidenza e una risoluzione dqz/qz del 10%.
Il Rapporti scientifici sulla natura studio ha scoperto che la proteina p7 dell'HCV si assembla all'interno della membrana lipidica in oligomeri che assumono la forma di un imbuto. La forma conica indica un orientamento proteico preferito, rivelando uno specifico meccanismo di inserimento della proteina, e contribuendo a delineare potenziali meccanismi target per lo sviluppo futuro di farmaci.
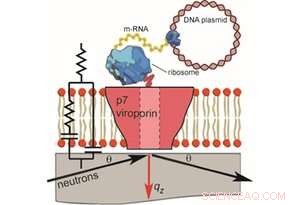
Figura 1. La preparazione senza cellule di doppi strati supportati contenenti misurazioni p7 e NR ed EIS (non in scala). Per la riflettività dei neutroni, membrane si sono formate su quarzo e un fascio di neutroni incidente è stato trasmesso attraverso il substrato e riflesso da Credito:Thomas Soranzo (Synthelis SAS, Università di Grenoble Alpes), Donald K. Martin (Università Grenoble Alpes), Jean-Luc Lenormand (Università Grenoble Alpes), ed Erik B. Watkins (Laboratorio Nazionale di Los Alamos)
Poiché la disfunzione delle proteine di membrana è anche correlata a un'ampia gamma di malattie, questo progresso nei metodi per analizzare le proteine di membrana nella loro condizione nativa, su scala atomica, ha anche il potenziale per aiutare a supportare nuovi approcci terapeutici in altre aree, come per lo sviluppo di anticorpi contro l'HIV.
Erik Watkins, ex scienziato dello strumento ILL FIGARO, ha dichiarato:"Questo nuovo approccio è un metodo semplice ed efficiente complementare ad altre tecniche strutturali e più complesse come NMR e cristallografia. Questo si è dimostrato un potente strumento per caratterizzare la conformazione della proteina nel suo ambiente naturale e uno che possiamo cercare di utilizzare per la membrana scoperte proteiche non solo negli avanzamenti nell'HCV, ma anche più lontano».
Bruno Tillier, Consigliere delegato, Synthelis ha aggiunto:"I neutroni si sono rivelati una risorsa chiave per questo progetto poiché avevamo bisogno di analizzare la struttura della proteina p7 in un ambiente specifico. Ora possiamo cercare di portare questa profonda comprensione del virus non solo sui dispositivi, come i biosensori, ma anche per studiare il comportamento delle proteine di membrana nei doppi strati lipidici in altri campi".
Donald Martin, Il capo del team di ricerca SyNaBi e professore all'Università di Grenoble Alpes ha anche affermato:"Questi nuovi risultati sono di buon auspicio per il nostro continuo sviluppo di nuovi sistemi e dispositivi nanostrutturati. La fruttuosa collaborazione in corso tra fisici, biologi e ingegneri di queste istituzioni a Grenoble forniscono l'importante comprensione fondamentale dei processi fisici e biologici che sta alla base dello sviluppo di tali sistemi e dispositivi nanostrutturati".
Tommaso Soranza, L'Università di Grenoble Alpes e l'ex scienziato di Synthelis hanno anche affermato:"un importante collo di bottiglia nell'analisi della riflettività dei neutroni delle proteine di membrana nel doppio strato planare è l'inserimento sufficiente di polipeptidi. Questo combinatorio, il nuovo metodo non solo consente un'incorporazione significativa di materiale, ma consente anche un'etichettatura specifica che potrebbe migliorare gli studi sulla struttura/funzione delle proteine di membrana".