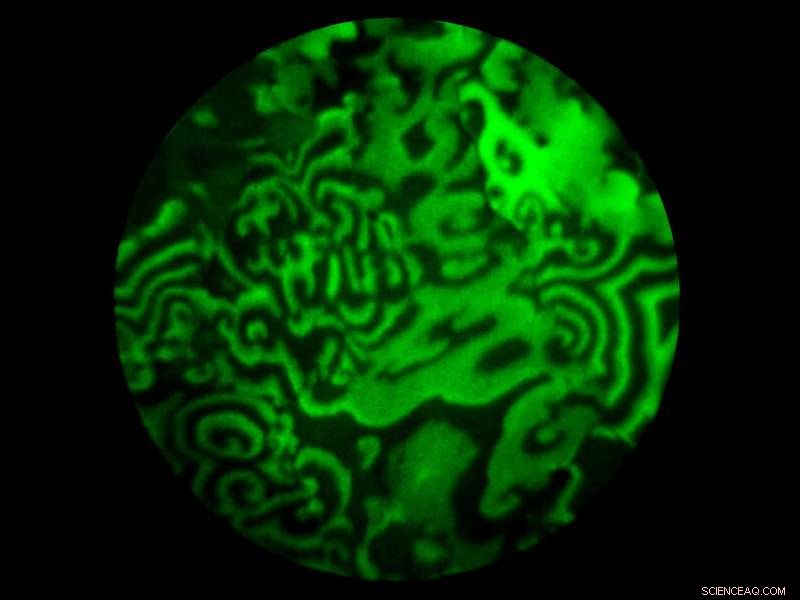
Strutture a spirale sul cristallo. Attestazione:TU Wien
Spettacolari immagini al microscopio elettronico alla TU Wien portano a importanti scoperte:le reazioni chimiche possono produrre onde multifrequenza simili a spirali e quindi fornire informazioni locali sui catalizzatori.
Sembrano quasi ipnotici, come una lampada di lava. Le onde rese visibili alla TU Wien utilizzando un microscopio elettronico a fotoemissione ricoprono la superficie della lamina di rodio con disegni bizzarri che danzano sulla superficie.
Le onde sono conosciute in molte forme molto diverse; come onde d'acqua, onde luminose o onde sonore. Ma qui abbiamo a che fare con qualcosa di molto diverso:le onde chimiche. Una reazione chimica avviene sulla superficie di un cristallo, ma questo non procede in una sola direzione:invece, ritorna periodicamente al suo stato originale. A seconda della fase di questa reazione che progredisce ciclicamente, la superficie del cristallo di rodio appare chiara o scura al microscopio elettronico a fotoemissione. Questo crea un modello d'onda in movimento. Il risultato rivoluzionario è stato osservare questo effetto simultaneamente su diversi granelli microscopicamente piccoli di un catalizzatore policristallino. Lì si formano affascinanti strutture a spirale, il cui movimento permette di raccogliere informazioni sulle caratteristiche dei singoli grani di cristallo.
Conigli, volpi e cristalli
Tipicamente, si immagina una reazione chimica come questa:da specifici reagenti iniziali si ottengono specifici prodotti finali. Ma non deve essere così semplice. Possono verificarsi oscillazioni autosufficienti, cioè cambiamenti periodici tra due stati diversi, " spiega il professor Günther Rupprechter dell'Istituto di chimica dei materiali presso TU Wien. Questo è noto da discipline scientifiche molto diverse, come i modelli di cacciatori-prede. Quando le volpi mangiano i conigli al punto che non ne rimangono quasi più, le volpi muoiono di fame e il loro numero diminuisce, e di conseguenza la popolazione di conigli si riprende. Modelli simili si verificano nei prezzi degli immobili; o anche nelle reazioni chimiche.
Il team della TU Wien sta studiando l'ossidazione dell'idrogeno, la base di qualsiasi cella a combustibile. Questi studi comportano l'esposizione di superfici di rodio a un'atmosfera di ossigeno e idrogeno. Inizialmente le molecole di ossigeno (O2) vengono adsorbite sulla superficie dove si dissociano in atomi di ossigeno. I singoli atomi di ossigeno possono quindi diffondersi nel cristallo e formare un sottile strato di ossigeno sotto lo strato esterno di rodio. Però, questo riduce la capacità della superficie di legare l'ossigeno. Sempre più, l'idrogeno è invece legato, che poi reagisce formando acqua con l'ossigeno precedentemente adsorbito. L'acqua esce di nuovo dalla superficie, ad un certo punto il numero di atomi di ossigeno è tornato al livello basso iniziale, e l'intero processo ricomincia dall'inizio.

Yuri Suchorski, Giovanni Bernardi, Johannes Zeininger, Martin Datler, Günther Rupprechter (da sinistra a destra). Attestazione:TU Wien
Diversi angoli, frequenza diversa
"Tali reazioni oscillanti erano già state studiate dal premio Nobel Gerhard Ertl, " spiega il professor Yuri Suchorski, il primo autore del saggio, chi, come il professor Rupprechter, ha lavorato all'Istituto di Berlino del professor Ertl prima di trasferirsi alla TU Wien. "Ma ora abbiamo compiuto un ulteriore importante passo avanti:siamo riusciti a raggiungere uno stato di numerose oscillazioni di frequenze diverse che si verificano contemporaneamente su diversi grani della superficie policristallina". Questi diversi grani presentano reticoli cristallini orientati con angoli diversi rispetto alla superficie.
Questi angoli giocano un ruolo cruciale:la disposizione geometrica degli atomi sulla superficie di un cristallo dipende dalla direzione in cui viene tagliato. Questo determina anche la frequenza con cui la reazione chimica subisce oscillazioni cicliche.
Su una superficie policristallina, vi sono poi diverse regioni in cui il processo ciclico avviene a frequenze diverse. È proprio questo effetto che crea quegli affascinanti motivi a onde. Quando un'onda chimica attraversa la superficie e passa dal bordo di un granello di cristallo all'altro, accelera o rallenta, simile alla luce che passa dall'aria all'acqua. Questo cambia le complesse strutture ondulatorie a spirale in base al particolare orientamento della superficie del grano. "Possiamo quindi imparare molto sul materiale da queste strutture, " dice Günther Rupprechter. "A colpo d'occhio possiamo rilevare quali regioni della nostra superficie hanno caratteristiche catalitiche superiori."
Sulla strada per l'energia dell'idrogeno del futuro
È necessario saperne di più sull'ossidazione catalitica dell'idrogeno. "Per le celle a combustibile, le fonti energetiche mobili del futuro il cui unico gas di scarico è costituito da acqua pura, abbiamo bisogno di nuovi materiali che aiutino a bruciare cataliticamente l'idrogeno. Ma come prima, questi processi non sono ancora del tutto compresi" afferma il professor Yuri Suchorski. "Ci sono ancora molte domande aperte qui, e ora abbiamo un nuovo, modo molto elegante per indagarli ulteriormente."