Utilizzando un tipo di microscopia elettronica all'avanguardia, un team guidato dal MIT ha scoperto la struttura di un enzima cruciale per mantenere un'adeguata fornitura di elementi costitutivi del DNA nelle cellule umane. Credito:Massachusetts Institute of Technology
Utilizzando un tipo di microscopia elettronica all'avanguardia, un team guidato dal MIT ha scoperto la struttura di un enzima cruciale per mantenere un'adeguata fornitura di elementi costitutivi del DNA nelle cellule umane.
La loro nuova struttura rivela anche il probabile meccanismo con cui le cellule regolano l'enzima, nota come ribonucleotide reduttasi (RNR). In modo significativo, il meccanismo sembra differire da quello della versione batterica dell'enzima, suggerendo che potrebbe essere possibile progettare antibiotici che bloccano selettivamente l'enzima batterico.
"Le persone hanno cercato di capire se esiste qualcosa di abbastanza diverso da poter inibire gli enzimi batterici e non la versione umana, "dice Catherine Drennan, un professore di chimica e biologia del MIT e un investigatore dell'Howard Hughes Medical Institute. "Considerando questi enzimi chiave e cercando di capire quali sono le differenze e le somiglianze, possiamo vedere se c'è qualcosa nell'enzima batterico che potrebbe essere preso di mira con farmaci a piccole molecole".
Drennan è uno degli autori senior dello studio, che appare nel numero del 20 febbraio della rivista eLife . JoAnne Stubbe, il Professore Emerito di Chimica Novartis al MIT, e Francesco Asturie, professore associato di biochimica presso la University of Colorado School of Medicine, sono anche autori anziani. Gli autori principali del documento sono il ricercatore del MIT Edward Brignole e l'ex postdoc dello Scripps Research Institute Kuang-Lei Tsai, che ora è assistente professore presso l'Università del Texas Houston Medical Center.
Un enzima insolito
L'enzima RNR, che si trova in tutte le cellule viventi, converte i ribonucleotidi (i mattoni dell'RNA) in desossiribonucleotidi (i mattoni del DNA). Le cellule devono mantenere una scorta sufficiente di questi elementi costitutivi, ma quando ne accumulano troppe, L'RNR viene disattivato da una molecola di deossinucleotide nota come dATP. Quando sono necessari più desossinucleotidi, una molecola correlata chiamata ATP si lega a RNR e lo riaccende.
Una caratteristica insolita di RNR è che può catalizzare la produzione di quattro diversi prodotti:le basi nucleotidiche spesso abbreviate come A, G, C, e T. Nel 2016, Drennan ha scoperto che l'enzima ottiene ciò cambiando la sua forma in risposta alle molecole regolatrici.
La maggior parte del lavoro precedente dei ricercatori sulla struttura RNR si è concentrato sulla versione trovata in E. coli . Per quegli studi, hanno usato la cristallografia a raggi X, una tecnica che può rivelare la struttura atomica e molecolare di una proteina dopo che è stata cristallizzata.
Nel nuovo studio, Drennan e i suoi colleghi hanno deciso di esaminare la versione umana di RNR. La struttura di questa proteina, che si è rivelata molto diversa dalla versione batterica, dimostrato sfuggente utilizzando la cristallografia a raggi X, che non funziona bene per le proteine che non cristallizzano facilmente. Anziché, i ricercatori si sono rivolti a una forma avanzata di microscopia nota come microscopia crioelettronica (crio-EM).
Fino a poco tempo fa, la crio-EM offriva tipicamente una risoluzione di circa 10-20 angstrom, che potrebbe rivelare la forma complessiva di una proteina ma nessun dettaglio sulla posizione e la forma delle unità strutturali più piccole al suo interno. Però, negli ultimi anni, i progressi tecnologici hanno portato a un'esplosione del numero di strutture che raggiungono risoluzioni di circa 3 angstrom. È abbastanza alto da tracciare le singole catene proteiche all'interno della molecola più grande, così come strutture interne come eliche e persino catene laterali di amminoacidi.
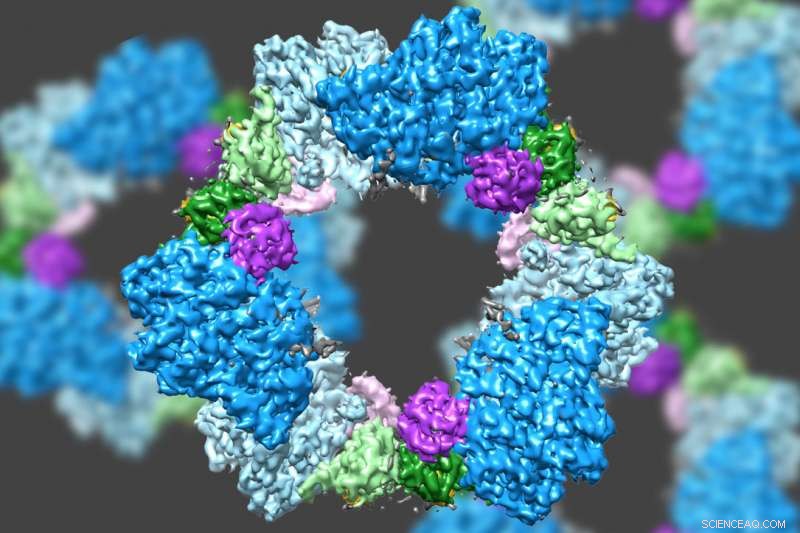
Gli scienziati sapevano già che l'RNR è costituito da due subunità proteiche note come alfa e beta. Usando la crio-EM, il team del MIT ha scoperto che la versione umana dell'enzima forma un anello formato da sei delle subunità alfa. Quando l'ATP, che attiva RNR, è legato all'enzima, l'anello è instabile e può essere facilmente aperto, permettendo alla subunità beta di farsi strada nell'anello. Questa unione di alfa e beta consente al sito attivo dell'enzima, situato nella subunità beta, per eseguire le reazioni chimiche necessarie per produrre deossinucleotidi.
Però, quando l'inibitore dATP è presente, l'anello diventa molto più rigido e non permette alla subunità beta di entrare. Ciò impedisce all'enzima di catalizzare la produzione di desossinucleotidi.
Progettazione di farmaci
Diversi farmaci antitumorali ora in uso o in fase di sviluppo mirano alla versione umana di RNR, interferendo con la capacità delle cellule tumorali di riprodursi limitando la loro fornitura di elementi costitutivi del DNA. Il team del MIT ha trovato prove che almeno uno di questi farmaci, clofarabina difosfato, agisce inducendo la formazione di anelli alfa rigidi di 6 unità.
Questo anello di 6 unità non si trova nella forma batterica di RNR, che invece si assembla in un anello distinto contenente quattro subunità alfa e quattro subunità beta. Ciò significa che potrebbe essere possibile progettare antibiotici che colpiscano la versione batterica ma non la versione umana, dice Drennan.
Ora ha in programma di studiare le strutture di altre molecole proteiche che sono difficili da studiare con la cristallografia a raggi X, comprese le proteine con cluster ferro-zolfo, che si trovano in molte vie metaboliche. Il lavoro di microscopia in questo studio è stato eseguito presso lo Scripps Research Institute, ma quando aprirà il nuovo edificio MIT.nano del MIT, ospiterà due microscopi crio-EM che saranno a disposizione della comunità del MIT e di altri potenziali utenti nell'industria e nel mondo accademico.
"I progressi tecnologici che hanno permesso alla crio-EM di raggiungere una risoluzione così elevata sono davvero entusiasmanti, "Drennan dice. "Sta davvero iniziando a rivoluzionare lo studio della biologia."