Credito:Bob Wilder/ Università di Buffalo
Elio, il secondo elemento più leggero dell'universo, ha svariati usi, dal tenere a galla i palloncini al raffreddare i magneti superconduttori.
È anche un gas nobile, così etichettato perché è stato a lungo ritenuto "troppo distaccato" per reagire con gli altri elementi della tavola periodica.
Ora, però, un team di scienziati guidati dalla California State University, Maosheng Miao, professore di chimica di Northridge (CSUN), e tra cui la professoressa di chimica dell'Università di Buffalo Eva Zurek, ha fornito una spiegazione teorica di come l'elio possa essere in grado di formare composti solidi stabili, le miriadi di combinazioni di elementi chimici che creano tutti i tipi di materiali.
La ricerca suggerisce anche che il gas, la cui offerta sulla Terra è diminuita, potrebbe essere trovato nel mantello terrestre, un luogo un tempo considerato improbabile poiché non c'era chimica nota per mantenere l'elio lì.
Il nuovo studio, "Reattività di He con composti ionici ad alta pressione, " è stato pubblicato il 5 marzo in Comunicazioni sulla natura . Il lavoro è stato ispirato da uno studio del 2017 in cui un diverso team di ricerca ha riferito di aver sintetizzato un composto stabile da elio e sodio, un elemento nel sale da cucina, sotto alta pressione.
Sebbene tale reazione sia stata dimostrata da esperimenti, Miao ha detto, "non capivamo perché potesse succedere. Ora lo sappiamo. L'elio è una buona 'tata'".
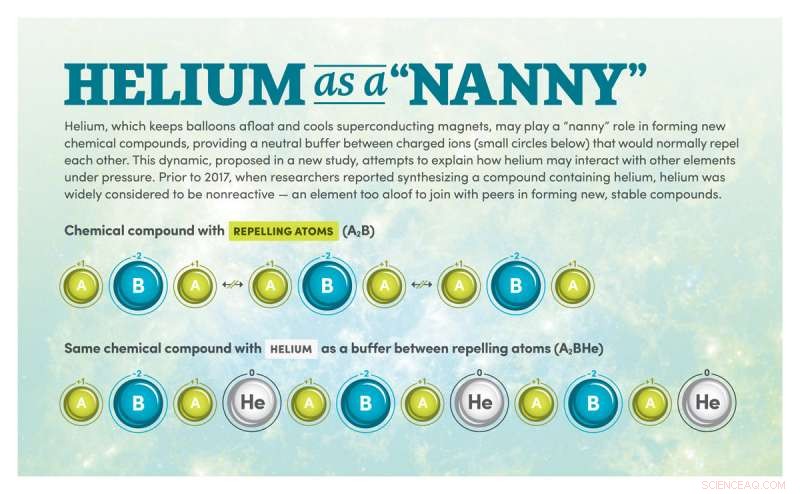
"Proponiamo che ci sia una forza trainante generale affinché l'elio reagisca con i composti ionici non appena questi composti hanno un numero disuguale di ioni caricati negativamente e positivamente, " disse Miao, dottorato di ricerca "Di conseguenza, stabilizza quella che normalmente sarebbe una situazione instabile, un po' come una tata media quando i tuoi figli non vanno d'accordo."
"La ricerca è fondamentalmente interessante perché l'elio è sempre stato considerato non reattivo, l'elemento che non reagisce con nulla, " ha detto il coautore dello studio Zurek, dottorato di ricerca, un professore di chimica presso l'UB College of Arts and Sciences. "La nostra ricerca illustra un nuovo meccanismo per cui l'elio potrebbe reagire con altre specie chimiche per formare composti sotto pressione. Inoltre, abbiamo previsto nuovi gruppi di composti che potrebbero anche reagire con l'elio sotto pressione che non sono stati studiati nel lavoro originale".
Oltre a Miao e Zurek, il team includeva gli studiosi in visita Zhen Liu e Jorge Botana del CSUN (postdoc presso il Beijing Computational Science Research Center in Cina); professore di fisica Andreas Hermann, dottorato di ricerca, dell'Università di Edimburgo nel Regno Unito; lo studente universitario di chimica CSUN Steven Valdez; professore di fisica Dadong Yan, dottorato di ricerca, dell'Università Normale di Pechino in Cina; e il professore di fisica Hai-qing Lin, dottorato di ricerca, direttore del Centro di ricerca sulla scienza computazionale di Pechino.
Il ruolo di "tata" di Helium
Gli ioni sono atomi o molecole con carica elettrica. In alcuni composti chimici stabili, uno ione caricato negativamente bilancia uno ione caricato positivamente. (Un esempio di questo è il sale da cucina, composto da ioni sodio con carica positiva e ioni cloro con carica negativa).
Ma quando i composti contengono un numero disuguale di ioni caricati negativamente e positivamente, la repulsione tra atomi con la stessa carica può portare la struttura a diventare instabile sotto pressione.
È qui che entra in gioco l'elio. "È un po' come la tata, " disse Miao.
"Gli elementi chimici si uniscono per formare un composto, una specie di famiglia, " ha spiegato. "Ma, come in ogni famiglia, non tutti vanno d'accordo, in questo caso perché hai troppi ioni negativi o positivi.
"Ora, faremo pressione per far funzionare questo composto, che è come mettere questa famiglia, questo composto, in una macchina molto piccola, "Continuò Miao. "Sai cosa succede quando costringi i tuoi figli a sedersi insieme sul sedile posteriore di una piccola macchina, a volte non vanno d'accordo, ci sono litigi e spinte. Bene, l'elio è la tata nell'auto di questo composto chimico. Si siede tra i bambini per aiutarli ad andare d'accordo, ma in realtà non fa parte della famiglia".
Nel caso di composti chimici, Miao ha spiegato, l'elio non forma alcun tipo di legame chimico con gli atomi vicini. Anziché, si inserisce tra gli elementi del composto per mantenerli stabili.
La nuova ricerca pone le basi per lo studio futuro dei composti dell'elio prevedendo ulteriori composti che sarebbero stabili sotto pressione, come un composto costituito da fluoruro di magnesio e un atomo di elio, e un altro costituito da fluoruro di calcio e un atomo di elio.
Più elio sulla Terra?
La leggerezza e l'ampio uso dell'elio significano che la riserva terrestre dell'elemento si sta lentamente esaurendo.
Miao ha detto che se la teoria della sua squadra si rivelasse vera:"Credo che lo farà, ed è stato parzialmente dimostrato" - non solo potrebbe fornire nuove intuizioni sul ruolo che l'elio gioca nei composti chimici, ma forniscono anche indizi su dove è possibile trovarne di più.
"Il nostro lavoro rivela che l'elio ha la propensione a reagire con un'ampia gamma di composti ionici anche a basse pressioni, il che implica che potrebbe essercene molto di più sulla Terra di quanto ci rendiamo conto, " ha detto. "Poiché la maggior parte dei minerali della Terra contiene un numero disuguale di ioni caricati positivamente e negativamente, il nostro lavoro suggerisce che grandi quantità di elio potrebbero essere immagazzinate nel mantello terrestre".