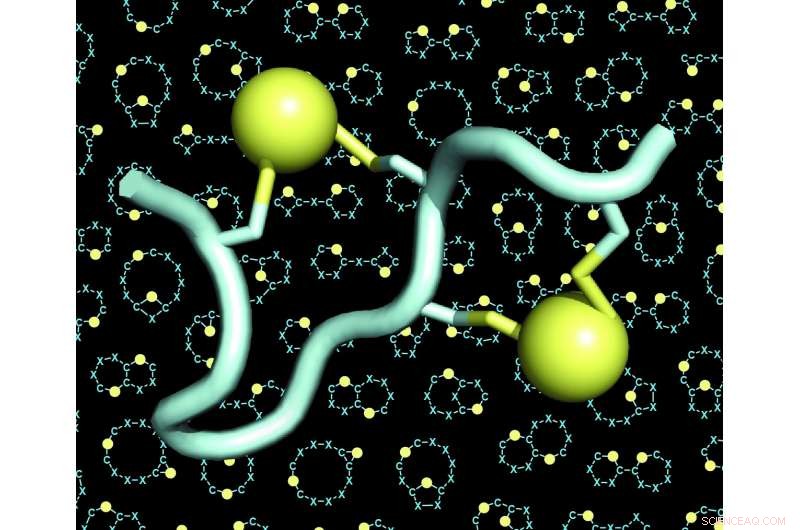
Un modello di un peptide a doppio ponte (il peptide in azzurro, i due ponti in giallo). Lo sfondo delle figure mostra molti esempi di scheletri (chiamati anche 'scaffold' o 'backbones') di peptidi a doppio ponte. Credito:C. Heinis/EPFL
I peptidi sono brevi catene di amminoacidi che possono legarsi alle proteine e modificarne la funzione. Mostrano un'elevata affinità di legame, bassa tossicità, e sono facili da sintetizzare, tutto ciò rende i peptidi ideali per l'uso nello sviluppo di farmaci, e molti peptidi naturali come l'insulina, ossitocina, la somatostatina e gli antibiotici vancomicina o polimixina B, sono ampiamente utilizzati.
Però, l'uso di peptidi come farmaci deve affrontare due sfide. Primo, affinità di legame:un buon legame richiede architetture peptidiche difficili e sequenze di amminoacidi che sono perfettamente complementari nella forma e si caricano sulla superficie delle loro proteine bersaglio. Secondo, stabilità dei peptidi:i peptidi possono essere potenzialmente tagliati dagli enzimi (proteasi) in più piccoli, frammenti inutili o anche singoli amminoacidi.
Il laboratorio di Christian Heinis all'EPFL ha ora affrontato entrambe queste sfide sviluppando il nuovo formato di peptidi che chiamano "peptidi a doppio ponte". Queste sono catene di 10-15 amminoacidi, quattro dei quali sono chimicamente collegati da due ponti. Ogni ponte collega una coppia di due amminoacidi cisteina, quattro in totale.
Poiché le quattro cisteine possono essere poste in molte configurazioni diverse lungo la sequenza degli amminoacidi, la strategia del doppio ponte ha consentito ai ricercatori di generare un numero enormemente elevato di architetture peptidiche strutturalmente diverse. Hanno ampliato ulteriormente la diversità utilizzando diversi reagenti chimici che hanno aumentato il numero di ponti. Gli scienziati hanno anche scoperto che le quattro cisteine potrebbero essere collegate da due linker in tre modi diversi, dando origine a tre diverse architetture da ogni singola sequenza peptidica.
Utilizzando questa strategia, i ricercatori hanno prodotto un'enorme diversità di strutture peptidiche, tutti con diverse strutture "scheletriche". Inoltre, i chimici hanno sistematicamente cambiato gli amminoacidi tra le cisteine e hanno generato librerie di miliardi di diversi peptidi a doppio ponte. Dopo aver selezionato le biblioteche, i ricercatori sono stati in grado di isolare leganti ad alta affinità a importanti bersagli proteici. Uno di questi obiettivi era callicrein, una proteina plasmatica associata ad angioedema ereditario, un raro disturbo del gonfiore. Un altro era l'interleuchina-17, una proteina citochina implicata in diversi disturbi infiammatori come l'artrite reumatoide e la psoriasi. Utilizzando l'approccio a doppio ponte per entrambi questi bersagli proteici, gli scienziati hanno sviluppato peptidi in grado di legarli in modo efficiente a concentrazioni nanomolari. Nel caso della callicreina, i peptidi potrebbero legarlo per più di un'ora prima di dissociarsi.
La stabilità era anche una caratteristica molto interessante del nuovo formato peptidico. I peptidi a doppio ponte sono difficilmente degradati dalle proteasi nel sangue, il che è un grande vantaggio perché impedisce che i peptidi vengano eliminati troppo rapidamente, estendendo così i loro effetti terapeutici. Sulla base dei risultati, Il laboratorio di Heinis sta ora applicando il formato peptidico a molti altri bersagli di malattie. Hanno già sviluppato nuovi, librerie di peptidi a doppio ponte ancora più grandi e le hanno analizzate contro una serie di bersagli rilevanti per la malattia. Uno di questi peptidi è già in fase di valutazione preclinica.