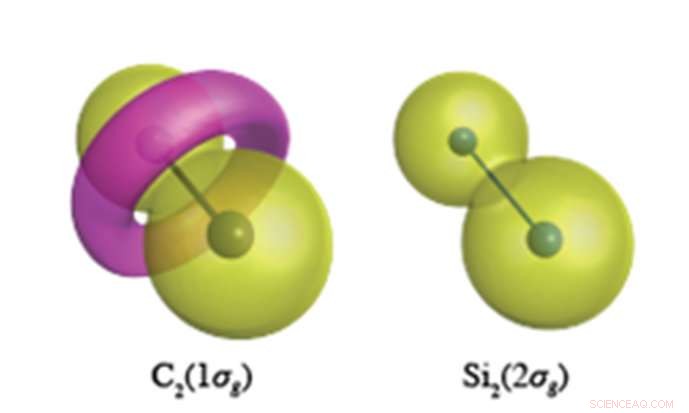
Ci si aspetta che gli elettroni del nucleo interno abbiano una funzione d'onda simile a una nocciolina come mostrato per Si 2 s elettroni (a destra). Nel legame C-C, però, gli elettroni C1s formano un toro come caratteristica di polarità opposta, mostrato in rosa nella figura a sinistra. Credito:Università Nazionale di Yokohama
I ricercatori di YNU hanno risolto l'antico mistero del perché il silicio non può sostituire il carbonio nei composti organici. Un nuovo calcolo chimico quantistico di riferimento di C 2 , si 2 , e i loro idruri rivelano una differenza qualitativa nelle topologie degli orbitali elettronici centrali delle molecole organiche e dei loro analoghi di silicio. I ricercatori propongono altri elementi con la propensione del carbonio a rimodellare le loro strutture nodali di elettroni centrali dopo il legame chimico.
Dalla scoperta del silicio e dal successo di Wöhler a metà del XIX secolo con la sintesi di composti organici, Lo stesso Wöhler fu tra i primi a suggerire di sostituire il carbonio con il silicio nei composti organici. È diventato chiaro all'inizio del XX secolo che il silicio non ha una chimica simile al carbonio, e i sogni di vita basata sul silicio sopravvivono solo nella fantascienza. Sappiamo empiricamente che il carbonio ha la capacità di formare una varietà di composti insaturi, che il silicio no. Però, la causa principale del perché solo il carbonio ha questa capacità è rimasta un mistero.
Calcoli chimici quantistici di accuratezza senza precedenti effettuati presso YNU rivelano che gli elettroni del nucleo (che non avrebbero dovuto partecipare al legame chimico) hanno un ruolo molto diverso nei composti insaturi di carbonio e silicio. Il carbonio ha la propensione ad alterare la topologia (struttura nodale) dei suoi elettroni centrali, quale, per C 2 , provoca la formazione di un anello toroidale nell'orbitale 1σg formato da elettroni C1s (vedi figura). si 2 , però, mantiene gli orbitali del nucleo sferici centrati in ogni sito atomico in tutte le sue molecole. Questa flessibilità degli orbitali centrali del carbonio consente al carbonio di formare una cornucopia di diverse strutture di legame di valenza, mentre il silicio è limitato alle strutture di legame ortogonali agli orbitali del nucleo sferico atomico.
L'impatto di questa scoperta è di vasta portata. Gli elettroni del nucleo sono stati finora assunti più o meno inerti, ma forse diventa necessario rivalutare il loro contributo al legame chimico, almeno nel caso dei legami insaturi. Finalmente, lo studio suggerisce che altri elementi, come l'azoto, fosforo, e fluoro, mostrano una flessibilità simile per modificare le loro topologie di elettroni principali, e quindi, mostrano una chimica altrettanto ricca.
La carta, "Topologie di elettroni centrali nei composti chimici:caso di studio del carbonio rispetto al silicio, " è pubblicato in Angewandte Chemie Edizione Internazionale vol 57(24) il 6 giugno, 2018.