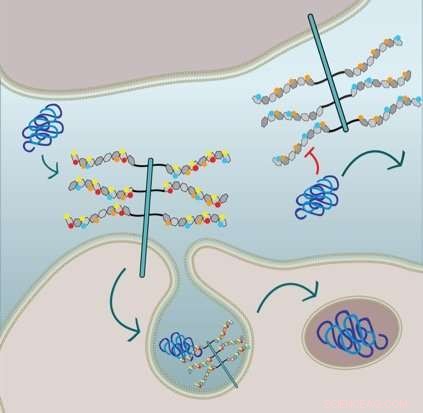
La figura mostra che l'assorbimento cellulare delle fibrille tau richiede la 6-O-solfatazione e la N-solfatazione delle catene laterali HSPG:La cellula nella metà inferiore esprime HSPG con tutte le frazioni solfato e internalizza la tau tramite macropinocitosi. La cellula nella metà superiore è geneticamente modificata e manca di N-solfatazione (cerchi rossi) e 6-O-solfatazione (cerchi gialli) e quindi, l'assorbimento delle fibrille tau è inibito. Credito:Sandi Jo Estill-Terpack, Barbara Stopschinsky
I vampiri possono trasformare gli umani in vampiri, ma entrare nella casa di un umano, devono essere invitati a entrare. Ricercatori dell'UT Southwestern Medical Center, scrivendo nel Journal of Biological Chemistry , hanno scoperto dettagli su come le cellule invitano all'interno di proteine corrotte che possono trasformare le proteine normali corrotte, portando a malattie neurodegenerative come il morbo di Alzheimer e il morbo di Parkinson. Comprendere i dettagli molecolari di come queste proteine si diffondono da cellula a cellula potrebbe portare a terapie per arrestare la progressione della malattia.
L'Alzheimer e il Parkinson sono associati a particolari proteine nel mal ripiegamento del cervello, aggregante, e inducendo le proteine normali a ripiegarsi male e ad aggregarsi. Il gruppo di Marc Diamond all'UT Southwestern ha scoperto nel 2013 che per entrare in nuove cellule e propagare il misfolding, le proteine associate alla malattia tau, alfa-sinucleina e beta-amiloide devono legarsi a un tipo di molecola zucchero-proteina chiamata proteoglicano eparan solfato (HSPG) sulla superficie della cellula. Questo legame fa sì che la cellula porti all'interno la proteina corrotta. Nel nuovo studio, il gruppo ha cercato di capire di più su come funzionava questo processo.
"La domanda era, quanto è specifico questo (processo)? O non è affatto specifico?" chiese Barbara Stopschinski, il medico e ricercatore nel laboratorio di Diamond che ha supervisionato il nuovo lavoro. Quali erano i dettagli della comunicazione chimica tra HSPG e tau che ha innescato l'ingresso di tau nelle cellule? Ed era questo processo diverso per l'alfa-sinucleina (associata al morbo di Parkinson), beta-amiloide e tau (entrambi associati al morbo di Alzheimer)?
Gli HSPG possono essere di diverse dimensioni e strutture; possono essere decorati con diverse fantasie di zuccheri, e gli zuccheri possono essi stessi contenere diversi modelli di gruppi contenenti zolfo (frazioni di solfato). Stopschinski ha testato sistematicamente come diversi modelli di porzioni di solfato influenzassero il legame e l'assorbimento nelle cellule dell'alfa-sinucleina, beta-amiloide e tau.
Ha scoperto che la tau piegata male poteva entrare nelle cellule solo attraverso un HSPG molto specificamente decorato e modificato. beta-amiloide e alfa-sinucleina, d'altra parte, erano più flessibili nei tipi di porzioni di solfato che ne hanno innescato l'assorbimento. Per di più, Stopschinski ha identificato gli enzimi nelle cellule che hanno creato particolari modelli di solfatazione negli HSPG. Quando questi enzimi sono stati rimossi, la tau piegata male non veniva più assorbita nelle cellule, presumibilmente perché le decorazioni in zucchero HSPG e i modelli di solfatazione sono cambiati, il che significa che la tau piegata male non conosceva più la password molecolare.
Il team ora vuole capire se questi processi funzionano allo stesso modo nel cervello come nelle colture di cellule cerebrali. Diamond spera che capire come le proteine corrotte si muovono tra le cellule cerebrali porterà a modi per fermarle.
"C'è qualcosa di davvero notevole nell'efficienza con cui una cellula occuperà questi aggregati, portali dentro e usali per farne altri, "Diamond ha detto. "Questa conoscenza ha importanti implicazioni per la nostra comprensione di come le malattie neurodegenerative peggiorano nel tempo. Poiché abbiamo identificato enzimi specifici che possono essere inibiti per bloccare questo processo, questo potrebbe portare a nuove terapie".