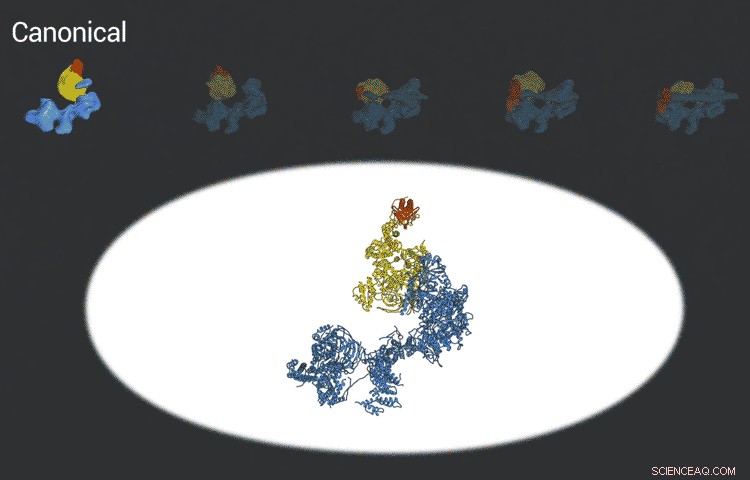
Il complesso del fattore di trascrizione IID si aggancia al DNA, controlla che sia nel posto giusto e poi recluta altre proteine per iniziare a trascrivere il DNA in RNA. I nuovi progressi nella crio-EM hanno permesso ai ricercatori di definire cinque distinte conformazioni di TFIID mentre si blocca e si carica. Credito:laboratorio Eva Nogales
Superare i limiti della microscopia crioelettronica, Università della California, Berkeley, gli scienziati hanno catturato i fermo immagine della forma mutevole di un'enorme molecola, una delle macchine molecolari chiave del corpo, poiché si aggancia al DNA e carica il macchinario per leggere il codice genetico.
La molecola, chiamato fattore di trascrizione IID, è fondamentale per la trascrizione di geni in RNA che verranno successivamente utilizzati come modelli per produrre proteine. A causa delle sue numerose parti mobili e delle sue grandi dimensioni, però, La struttura 3D di TFIID è stata difficile da catturare:le parti in movimento diventano sfocate.
Crio-EM, una tecnica di imaging i cui scopritori hanno vinto il Premio Nobel 2017 per la Chimica, è l'unico modo per ottenere un'istantanea di ingombranti, strutture floppy come questa. Le informazioni strutturali ad alta risoluzione sono essenziali per capire come TFIID traduce le istruzioni operative nel nostro genoma e come a volte va in tilt.
Il nuovo, istantanee più dettagliate delle parti mobili della molecola potrebbero aiutare i progettisti di farmaci a creare farmaci che interferiscono con i cambiamenti strutturali della molecola al fine di modificare l'espressione di un gene che sta causando la malattia.
"Queste strutture ti danno il potenziale per progettare razionalmente piccole molecole che disturberanno la normale funzione, perché ora non abbiamo una sola struttura, abbiamo molte strutture, che è ancora più potente perché possiamo indirizzare il movimento che stiamo vedendo in questo momento, " disse Eva Nogales, un professore di biologia molecolare e cellulare alla UC Berkeley e uno scienziato della facoltà al Lawrence Berkeley National Laboratory.
Nogales e i suoi colleghi, soprattutto gli studenti laureati della UC Berkeley Avinash Patel e Robert Louder, hanno pubblicato i loro risultati online questa settimana prima della pubblicazione cartacea sulla rivista Scienza .
"Dove infili quel farmaco e come lo fai funzionare dipende fortemente dalla natura transitoria di queste strutture, e questo è qualcosa che ci siamo resi conto solo di recente, " ha detto Robert Tjian, un professore di biologia molecolare e cellulare dell'Università di Berkeley che ha scoperto il TFIID e ha lavorato sulla molecola per gran parte della sua carriera, sebbene non fosse un coautore del nuovo articolo. "Poiché queste molecole si muovono e le loro strutture sono così complicate, la scoperta di farmaci convenzionali non rivelerebbe mai cosa sta succedendo. Le strutture di Eva lo cambieranno. Questo ha il potenziale per aprire l'universo di bersagli drogabili".
Molecole di congelamento
TFIID è un agglomerato di più di una dozzina di proteine distinte che alloggia in un promotore, una regione del DNA che controlla la trascrizione di un gene vicino, e verifica la sequenza per assicurarsi che sia atterrata nel punto giusto. Una volta confermato questo, si apre per reclutare dozzine di altre proteine che poi iniziano a muoversi lungo il gene, usando la sequenza del DNA come stampo per creare una sequenza complementare di RNA, chiamato RNA messaggero. Questo poi si fa strada fuori dal nucleo nel corpo della cellula, dove viene tradotto da altre macchine molecolari in proteine.
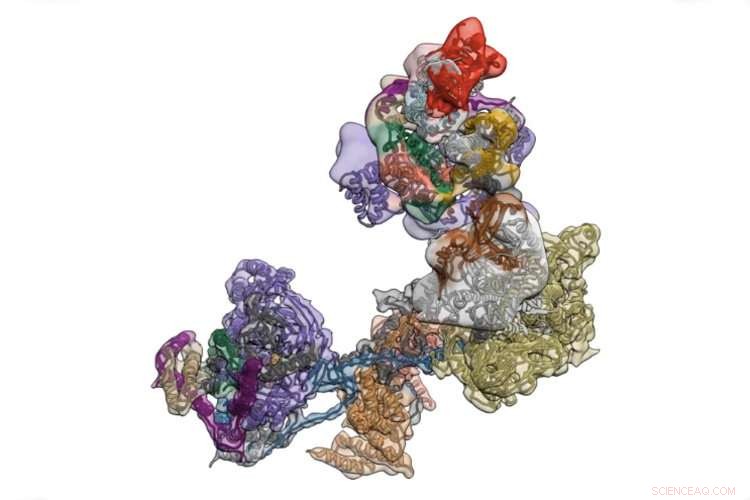
TFIID è un complesso di proteine che avvia la trascrizione delle istruzioni operative del corpo codificate nel DNA. Credito:Università della California - Berkeley
"Il TFIID è probabilmente la struttura più difficile che qualcuno abbia cercato di risolvere, perché è massiccio ed è altamente flessibile, " ha detto Tjian. "L'unico modo per vedere queste strutture molto flessibili è tramite crio-EM, ed Eva ora può congelare tutti questi diversi stati flessibili e descrivere il movimento".
Cryo-EM comporta il congelamento di una goccia contenente milioni di copie di una molecola, in ogni orientamento immaginabile, e utilizzando un microscopio elettronico per determinare la struttura combinando le immagini per definire la forma 3-D. Poiché TFIID ha molte parti mobili poiché si lega al DNA e si prepara a trascrivere un gene, la media di tutte le posizioni congelate produce un'immagine sfocata.
Nogales confronta i precedenti sforzi nell'imaging TFIID, compresi i suoi tentativi risalenti a quasi 20 anni fa, fotografare una squadra di calcio in campo e fare la media dei movimenti di tutti i giocatori. Il risultato è un torso umano generico con la testa e gli arti sfocati.
Immaginare il campo da calcio
Ora, grazie a più di due anni di intenso lavoro di Patel e Louder, è possibile acquisire immagini a risoluzione più elevata che sono simili a distinguere il calcio di gamba di un attaccante dalla parata di mano di un portiere e il colpo di testa di un terzino.
"Immagina di avere un'immagine dei 22 calciatori in campo, e dovevi combinarli in un'unica unità che chiameresti il "calciatore generico", '", ha detto. "Sembrerà un'immagine sfocata, a malapena si vede che è una forma umanoide e che c'è una sorta di movimento, ma non ti rendi conto che esiste una differenza tra i giocatori".
Le immagini migliorate sono il risultato di rivelatori migliori sviluppati originariamente dai colleghi del Berkeley Lab, e algoritmi informatici in costante miglioramento per analizzare le enormi quantità di dati raccolti dai rilevatori. Ciò ha aiutato Nogales e il suo team a definire cinque strutture distinte della molecola TFIID.
"Essi coprono l'intera sequenza di legame:prima di legarsi al DNA, vincolo iniziale al promotore, subsequent binding after it double checks that this is the right place, and the final state, " Nogales said.
She and her colleagues continue to push the limits of cryo-EM, hoping to determine the 3-D structure of TFIID after other transcription proteins land on it to complete the transcription process.