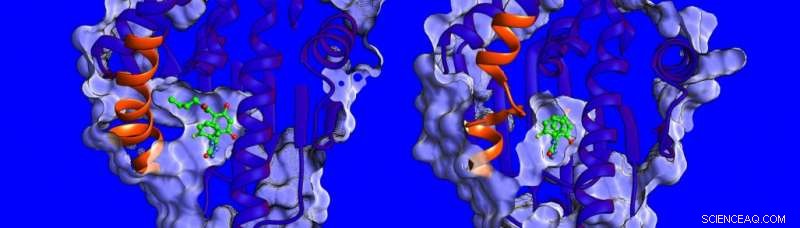
Differenze nella struttura e nella dinamica della regione elicoidale (mostrata in arancione) della proteina HSP90. Credito:Istituto di Heidelberg per gli studi teorici
Uno studio congiunto industria/università su una proteina bersaglio del cancro rivela una relazione insolita tra la flessibilità del sito di legame e la durata del bersaglio del farmaco. I risultati, pubblicato in Comunicazioni sulla natura , suggerire una nuova strategia per la scoperta di farmaci. La ricerca è stata condotta nell'ambito del consorzio Kinetics for Drug Discovery K4DD, sostenuto dall'Innovative Medicines Initiative.
La maggior parte dei farmaci esercita il proprio effetto terapeutico legandosi a una molecola proteica bersaglio, interferendo così con la normale funzione della proteina. Tradizionalmente, è stato considerato che quanto più un farmaco si lega alla sua proteina bersaglio, cioè maggiore è la sua affinità di legame, più sarà efficace. Però, i farmaci devono funzionare nell'ambiente in continua evoluzione degli organismi viventi. È quindi sempre più riconosciuto che non solo l'affinità di legame e la termodinamica, ma anche i tempi e la cinetica di residenza del farmaco bersaglio devono essere ottimizzati durante il processo di scoperta del farmaco.
Cinetica messa alla prova:studio di un bersaglio contro il cancro
Un team multidisciplinare di scienziati dei partner di K4DD Merck KGaA (Darmstadt), Istituto di Heidelberg per gli studi teorici (HITS), e l'Instituto de Biologia Experimental e Tecnológica (iBET) (Lisbona), applicato approcci sperimentali e computazionali all'avanguardia per studiare i determinanti dei tempi di residenza del bersaglio per una serie di inibitori di un bersaglio del cancro ampiamente studiato, proteina da shock termico 90 (HSP90). Gli inibitori di HSP90 possono interrompere il ciclo cellulare e potenzialmente fermare la crescita del tumore. Il team ha recentemente pubblicato alcuni dei loro risultati in Comunicazioni sulla natura .
Risultati sorprendenti:una maggiore mobilità del sito di legame porta a tempi di residenza più lunghi
"Al momento, si sa poco dei fattori che influenzano i tempi di residenza del farmaco bersaglio, quindi abbiamo deciso di misurare la termodinamica e la cinetica del legame, risolvere le strutture dei complessi HSP90-inibitore e simularne la dinamica, "dice la dottoressa Marta Amaral, uno degli autori corrispondenti. Le strutture determinate dalla cristallografia a raggi X mostrano che la tasca di legame di HSP90 è rivestita da una regione che può assumere la forma di un'elica o di un'ansa quando legata a diversi inibitori (vedi immagine sotto).
I ricercatori hanno scoperto che i composti che si legano con un'elica presente si legano per un tempo più lungo. "Siamo rimasti davvero sorpresi, " dice la prof.ssa Rebecca Wade (HITS), "quando abbiamo scoperto che un importante contributo ai lunghi tempi di permanenza era la maggiore mobilità della regione elicoidale della tasca di legame quando l'inibitore si legava". Questo insolito meccanismo di legame apre una nuova strada per la progettazione di farmaci:gli scienziati possono considerare obiettivi proteici meno rigidi e identificare molecole che stabilizzano forme più mobili della proteina al momento del legame, un po' come uno scarpone da sci con una fodera interna adattabile che si adatta continuamente al piede. I risultati di questo studio suggeriscono un nuovo modo per trovare farmaci candidati più efficaci con proprietà cinetiche e termodinamiche ottimali.