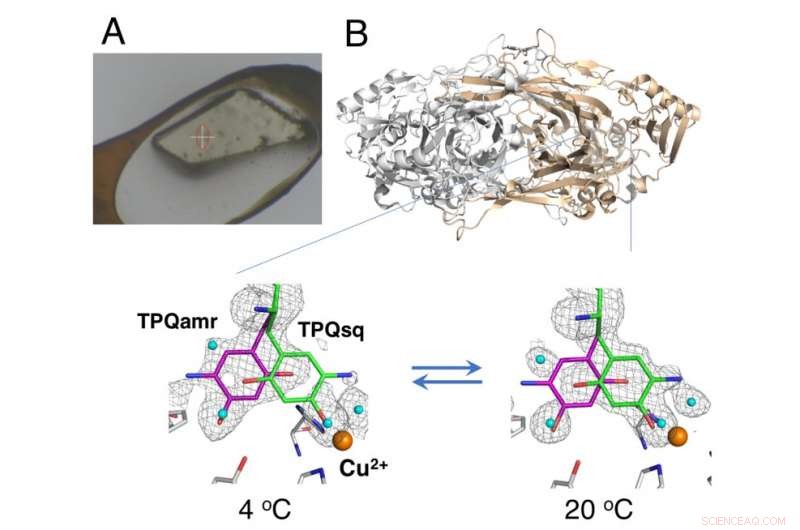
Cristallo non crio raffreddato montato utilizzando il metodo HAG (A) e variazione di equilibrio dipendente dalla temperatura di intermedi catalitici in ammina ossidasi di rame (B). Credito:Università di Osaka
Gli enzimi, biocatalizzatori costituiti da proteine, sono molecole estremamente importanti che catalizzano le reazioni e i processi negli organismi viventi. Il lavoro in corso per comprendere le loro strutture e meccanismi di reazione è quindi vitale per ampliare le nostre conoscenze e contribuire ai progressi scientifici e medici.
Cristallografia a raggi X:in cui i cristalli proteici sono esposti a un raggio di raggi X, risultante in modelli di diffrazione specifici che possono essere analizzati, è la tecnica più utilizzata per la determinazione strutturale delle proteine. La raccolta dei dati in cristallografia a raggi X di solito comporta il posizionamento di cristalli sotto un flusso di gas criogenico a 100 K; però, le condizioni criogeniche generalmente non consentono l'analisi termodinamica dei cambiamenti conformazionali nei cristalli proteici. Ora, ricercatori dell'Università di Osaka, Istituto Superiore di Medicina di Osaka, Istituto giapponese di ricerca sulle radiazioni di sincrotrone (JASRI), e RIKEN hanno riportato i dettagli dei cambiamenti strutturali durante la reazione catalitica di un'ammina ossidasi di rame utilizzando una tecnica non criogenica. I loro risultati sono stati pubblicati in PNAS .
Lo studio ha utilizzato un metodo "aria umida e rivestimento con colla (HAG)" sviluppato da JASRI presso l'impianto di sincrotrone SPring-8. Invece del raffreddamento criogenico, i cristalli proteici non congelati sono stati rivestiti con un polimero solubile in acqua e posti sotto un flusso di gas di azoto umido a temperatura controllata con precisione. Ciò ha permesso al cristallo quasi nudo di rimanere abbastanza stabile da consentire al team di valutare l'equilibrio tra le conformazioni strutturalmente distinte del cofattore redox (un componente essenziale della reazione catalitica) a una particolare temperatura.
"Grazie al preciso controllo della temperatura che siamo stati in grado di ottenere, abbiamo dimostrato il primo successo nell'analisi cristallotermodinamica dell'enzima di lavoro, ", afferma l'autore corrispondente dello studio Toshihide Okajima. "Le analisi termodinamiche basate sulle misurazioni dei cristalli forniscono una rappresentazione più ravvicinata dei cambiamenti strutturali rispetto ai dati acquisiti dagli studi sulle soluzioni, e sono quindi più preziosi per la nostra comprensione."
Inoltre, i parametri termodinamici ottenuti hanno mostrato un comportamento simile a quello del citosol all'interno delle cellule. Si ritiene quindi che le condizioni HAG possano fornire un modello utile per le condizioni fisiologiche. Sono state riportate varie altre tecniche cristallografiche per l'uso a temperatura ambiente; però, richiedono laser specializzati senza raggi X.
"Utilizzando il metodo HAG a temperatura controllata, abbiamo dimostrato che è possibile acquisire informazioni conformazionali utilizzando un normale fascio di raggi X, " Spiega Okajima. "Ci auguriamo che l'accessibilità della tecnica e le sue possibilità di fornire informazioni termodinamiche la rendano un'importante aggiunta agli attuali approcci cristallografici".