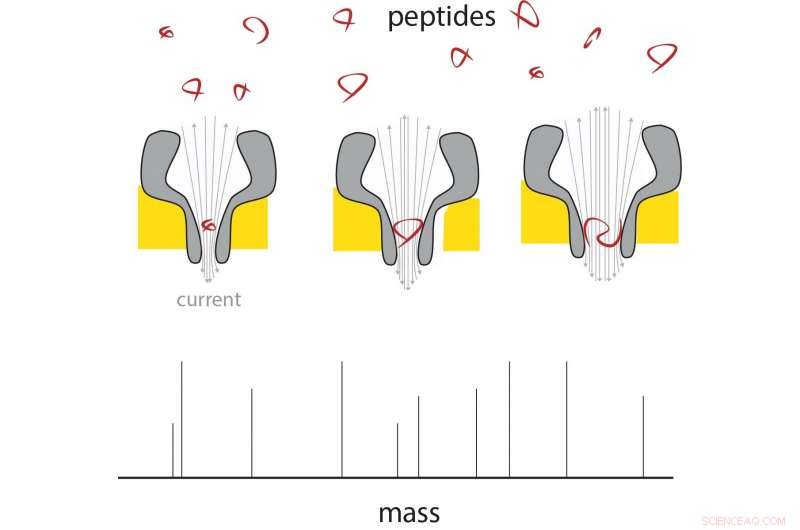
Un peptide entra nell'estremità sottile del nanoporo, e lì cambia la corrente in proporzione alla sua massa. Utilizzando nanopori di dimensioni diverse, può essere misurata una gamma di dimensioni dei peptidi. Crediti:G. Maglia / Università di Groningen
Gli scienziati dell'Università di Groningen hanno sviluppato nanopori per misurare direttamente la massa dei peptidi. Sebbene la risoluzione necessiti di miglioramenti, questa prova di principio mostra che uno spettrometro di massa peptidico economico e portatile può essere costruito utilizzando la tecnologia dei nanopori esistente e i pori brevettati che sono stati sviluppati nel laboratorio dell'Università di Groningen Professore Associato di Biologia Chimica, Giovanni Maglia. Un articolo su questa scoperta è stato pubblicato su Comunicazioni sulla natura il 19 febbraio.
Gli spettrometri di massa sono preziosi per lo studio delle proteine, ma sono entrambi ingombranti e costosi, che ne limita l'utilizzo a laboratori specializzati. "Ancora, la prossima rivoluzione negli studi biomedici sarà nella proteomica, l'analisi su larga scala di proteine che sono espresse in diversi tipi di cellule, " dice Maglia. Perché sebbene ogni cellula del tuo corpo porti lo stesso DNA, la produzione di proteine differisce enormemente tra i tipi di cellule. "E anche, le proteine vengono modificate dopo che sono state prodotte, ad esempio aggiungendo zuccheri che possono influire sulla loro funzione."
Messa
La tecnologia nanopore potrebbe offrire un modo per analizzare singole molecole. Nei lavori precedenti, Maglia ha già dimostrato che i nanopori biologici possono essere utilizzati per misurare i metaboliti e identificare proteine e peptidi. Questi pori sono grandi strutture proteiche, incorporato in una membrana. Le molecole che entrano in un poro o lo attraversano causano un cambiamento nella corrente elettrica attraverso il poro. "Un problema nella misurazione della massa dei peptidi è che passano troppo velocemente anche attraverso il più piccolo poro biologico per ottenere una lettura, " spiega Maglia.
Rendere i pori più piccoli è stata una sfida. "I pori sono costituiti da un numero di monomeri, quindi inizialmente abbiamo modificato l'interazione tra questi monomeri, ma non ha funzionato". infatti ha portato a pori costituiti da un numero minore di monomeri, che ha ridotto la dimensione dei pori.
I pori più piccoli di sempre
Maglia è stata quindi in grado di produrre pori a forma di imbuto che, alla loro estremità stretta, misurato solo 0,84 nanometri. "Questi sono i pori biologici più piccoli mai prodotti." La sfida successiva era garantire che i peptidi passassero attraverso i pori, indipendentemente dalla loro composizione chimica. "I pori hanno una carica negativa, che è necessario per il loro corretto funzionamento, " spiega Maglia.
La carica fa scorrere l'acqua attraverso il poro, trascinando i peptidi. Ma i peptidi con carica negativa verrebbero respinti dalla carica negativa all'estremità sottile dell'imbuto. Maglia modificò la carica alterando l'acidità dei fluidi utilizzati. "Infine, siamo riusciti a trovare le giuste condizioni impostando l'acidità ad un pH esattamente di 3,8. Ciò consente ai peptidi caricati negativamente di passare mantenendo un flusso d'acqua abbastanza grande attraverso i pori".
Risoluzione
Le misurazioni su nanopori di diverse dimensioni mostrano che la corrente elettrica è lineare con il volume del peptide che lo attraversa. Questi peptidi variavano da 4 a 22 amminoacidi in lunghezza. La differenza tra gli amminoacidi alanina e glutammato potrebbe essere misurata in questo sistema, il che significa che la risoluzione è di circa 40 Dalton (una misura della massa proteica). "La risoluzione degli spettrometri di massa convenzionali è molto migliore, ma se potessimo rendere il sistema circa quaranta volte più sensibile, sarebbe già utile nella ricerca proteomica, " dice Maglia. Ci sono diversi modi per migliorare la risoluzione, dice Maglia. "Potremmo progettare il nanoporo con amminoacidi artificiali, o utilizzare ioni diversi nelle nostre soluzioni, ridurre il rumore modificando la temperatura eccetera."
Il sistema dei nanopori ha diversi punti di forza unici:misura singole molecole, la tecnologia stessa è già disponibile in commercio ed è relativamente economica. Per di più, il sistema a nanopori è portatile. E, utilizzando molti pori diversi in un dispositivo, è possibile misurare contemporaneamente peptidi di dimensioni diverse e persino modifiche peptidiche. "Tutto ciò significa che uno spettrometro di massa versatile ed economico per l'analisi dei peptidi è fattibile, " dice Maglia. "E questo significherebbe che più laboratori potrebbero permettersi di condurre studi di proteomica molto importanti".