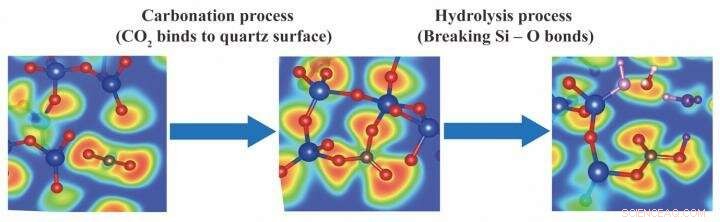
Il colore rosso indica che la probabilità di occorrenza degli elettroni di valenza è del 100%, il colore blu significa che non esistono elettroni nell'area, e il colore verde significa gas di elettroni libero che indica il confine dei legami covalenti. Rosso, le sfere blu e marroni rappresentano l'ossigeno, silicio e atomi di carbonio, rispettivamente. Credito:Istituto internazionale per la ricerca sull'energia a emissioni zero (I²CNER), Università di Kyushu
L'umanità ha bisogno di migliorare quando si tratta di ridurre le emissioni di carbonio per prevenire gli effetti peggiori del cambiamento climatico. Se il mondo vuole raggiungere l'obiettivo minimo dell'IPCC di mantenere l'aumento della temperatura globale al di sotto di 1,5 °C, ogni possibile via per la CO 2 la riparazione deve essere esplorata.
La cattura geologica può svolgere un ruolo importante qui. Le rocce e i sedimenti sotterranei del nostro pianeta offrono un vasto spazio potenziale per lo stoccaggio del carbonio a lungo termine. Per supportare questo, un recente studio computazionale di un gruppo internazionale guidato dal Giappone presso l'Università di Kyushu mostra come l'anidride carbonica intrappolata possa essere convertita in minerali innocui.
Le rocce sotto la superficie terrestre sono altamente porose, e l'intrappolamento comporta l'iniezione di CO 2 nei pori dopo averlo raccolto dalla sua fonte di emissione. Sebbene CO 2 è generalmente considerato troppo stabile per reagire chimicamente con la roccia, può legarsi strettamente alla superficie per adsorbimento fisico. Alla fine si dissolve in acqua, formazione di acido carbonico, che può reagire con metalli acquosi per formare minerali carbonati.
"La mineralizzazione è il metodo più stabile di CO . a lungo termine 2 Conservazione, blocco CO 2 in una forma completamente sicura che non può essere riemessa, " spiega Jihui Jia dell'International Institute for Carbon-Neutral Energy Research (I 2 CNER), Università di Kyushu, primo autore dello studio. "Una volta si pensava che questo richiedesse migliaia di anni, ma questa visione sta cambiando rapidamente. Le reazioni chimiche non sono completamente comprese perché sono così difficili da riprodurre in laboratorio. È qui che entra in gioco la modellazione".
Come riportato in Il Giornale di Chimica Fisica C , le simulazioni sono state inizialmente eseguite per prevedere cosa succede quando l'anidride carbonica si scontra con una superficie di quarzo spaccata-quarzo (SiO 2 ) essendo abbondante nella crosta terrestre. Quando le traiettorie di simulazione sono state riprodotte, il CO 2 le molecole sono state viste piegarsi dalla loro forma lineare O=C=O per formare CO . trigonale 3 unità legate al quarzo.
In una seconda serie di simulazioni, h 2 Le molecole di O sono state aggiunte per imitare "l'acqua di formazione" che è spesso presente sotto i siti di trivellazione di petrolio e gas. intrigante, l'H 2 Le molecole di O attaccano spontaneamente la CO . reattiva 3 strutture, rompendo i legami Si-O per produrre ioni carbonato. Proprio come l'acido carbonico, ioni carbonato possono reagire con cationi metallici disciolti (come Mg 2 + , Circa 2 + , e Fe 2 + ) per legare il carbonio in modo permanente in forma minerale.
Insieme, le simulazioni mostrano che entrambi i passaggi di CO 2 la mineralizzazione - carbonatazione (legandosi alla roccia) e idrolisi (reagendo con l'acqua) - sono favorevoli. Inoltre, gli ioni carbonato liberi possono essere prodotti per idrolisi, non solo per dissociazione dell'acido carbonico come si pensava una volta. Queste intuizioni si basavano su una forma sofisticata di dinamica molecolare che modella non solo le collisioni fisiche tra atomi, ma trasferimento di elettroni, l'essenza della chimica.
"I nostri risultati suggeriscono alcuni modi per migliorare la cattura geologica, ", afferma l'autore principale dello studio Takeshi Tsuji. "Per il quarzo per catturare CO 2 , deve essere una superficie spaccata, quindi gli atomi di silicio e ossigeno hanno legami "pendenti" reattivi. Nella vita reale, però, la superficie potrebbe essere protetta da legami idrogeno e cationi, che impedirebbe la mineralizzazione. Abbiamo bisogno di un modo per rimuovere quei cationi o deidrogenare la superficie".
Stanno crescendo le prove che la CO . catturata 2 può mineralizzare molto più velocemente di quanto si credesse in precedenza. Mentre questo è eccitante, l'articolo di Kyushu sottolinea quanto complessa e delicata possa essere la chimica. Per adesso, il gruppo raccomanda ulteriori studi su altre rocce abbondanti, come basalto, per mappare il ruolo che la cattura geochimica può svolgere nella più grande sfida tecnica che la civiltà deve affrontare.