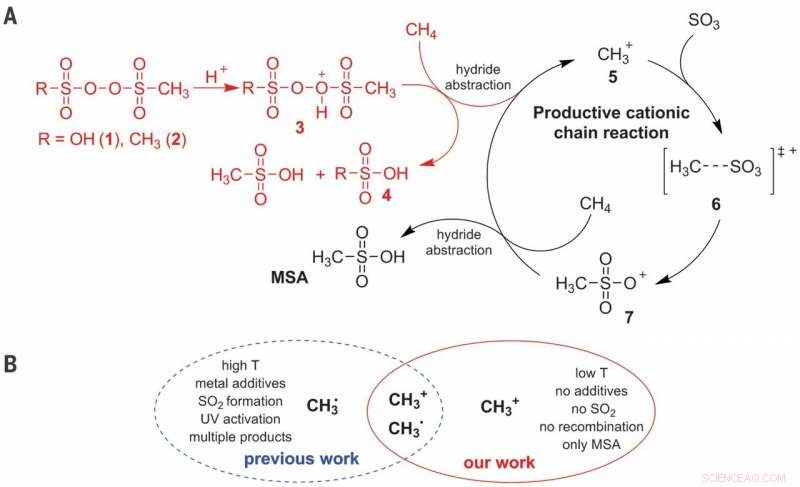
(A) Meccanismo di reazione ionica proposto per l'attivazione C–H di CH4 nella produzione selettiva di MSA (acido metansolfonico). (B) Vantaggi della via cationica rispetto alla via radicale. T, temperatura. Credito:Scienza, doi:10.1126/science.aav0177
Il metano è un componente importante nel gas naturale e una delle molecole più difficili per l'attivazione controllata, poiché la maggior parte del prodotto produce anidride carbonica. La conversione industriale del metano in derivati dell'alcol si basa tipicamente su un percorso tortuoso che inizia con l'iperossidazione a monossido di carbonio. Sebbene approcci più diretti abbiano mostrato risultati promettenti in mezzi altamente acidi su piccola scala, non sono abbastanza convenienti. In un recente studio ora pubblicato in Scienza , Christian Díaz-Urrutia e Timo Ott del dipartimento di ricerca e sviluppo di Grillo-Werke AG Company descrivono una reazione su scala di un impianto pilota che combinava direttamente il metano (CH 4 ) e anidride solforosa (SO 3 ) in acido solforico (H 2 COSÌ 4 ) per formare metansolfonico (CH 4 oh 3 S) acido senza sottoprodotti. La reazione sembrava procedere attraverso un meccanismo a catena cationica iniziato aggiungendo una bassa concentrazione di perossido di solfonile, propagato da metenio (CH 3 + ) molecole.
La funzionalizzazione diretta del metano per formare prodotti a valore aggiunto è una sfida a causa della potenziale sovraossidazione in molti ambienti di reazione e la solfonazione è un approccio interessante per ottenere la selettività di interesse. Nel processo pratico, Díaz-Urrutia e Ott hanno prodotto acido metansolfonico (MSA) utilizzando solo due reagenti principali; metano e anidride solforosa. Hanno raggiunto il 99 percento di selettività e resa di MSA nel lavoro. Gli scienziati hanno basato l'iniziatore elettrofilo su un derivato del perossido di solfonile, che hanno protonato in condizioni superacide per produrre un atomo di ossigeno altamente elettrofilo in grado di attivare un legame CH del metano. Hanno proposto studi meccanicistici per supportare la formazione di un catione metenio (CH 3 + ) come intermedio chiave durante la reazione. Il metodo proposto è scalabile con reattori collegati in serie per produrre in prospettiva fino a 20 tonnellate di MSA all'anno.
Mentre le tecniche di fracking su larga scala e la produzione di biogas hanno consentito l'accesso a grandi quantità di metano inattivo, la più grande trasformazione chimica del metano rimane confinata ai processi Fischer-Tropsch, che richiedono molta energia. Attualmente, il metano viene convertito industrialmente in Syngas, una miscela di monossido di carbonio e idrogeno, per formare prodotti utili tra cui metanolo e idrocarburi Fischer-Tropsch, che vengono sintetizzati in fasi successive. La produzione di syngas è fortemente costrittiva, però; Gli impianti "MegaMethanol" o il complesso di perle Fischer-Tropsch in Qatar superano i 10 milioni di tonnellate (MT) della produzione totale annua di idrocarburi. Di conseguenza, la conversione diretta del metano in prodotti di valore su una tecnica economicamente valida sono di estremo interesse.
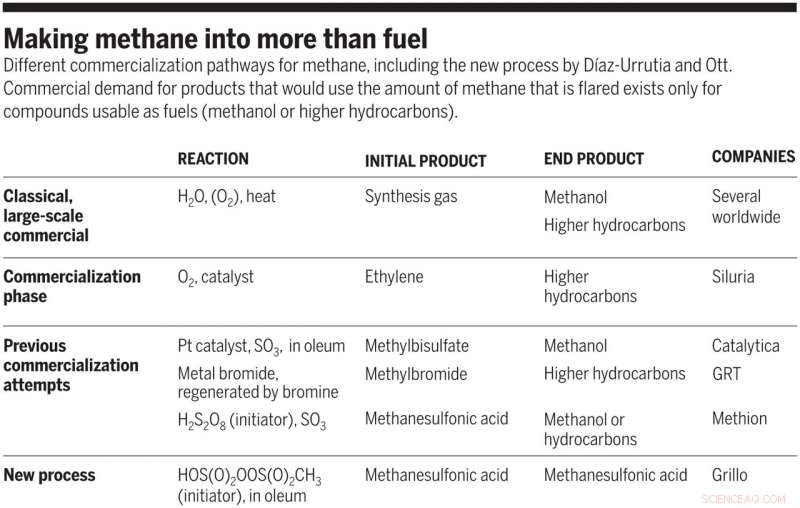
Trasformare il metano in qualcosa di più del carburante. Diversi percorsi di commercializzazione del metano, compreso il nuovo processo di Díaz-Urrutia e Ott. La domanda commerciale di prodotti che utilizzerebbero la quantità di metano bruciata esiste solo per composti utilizzabili come combustibili (metanolo o idrocarburi superiori). Credito:Scienza, doi:10.1126/science.aav0177
In tale contesto, il potenziale per solfonare il metano (CH 4 ) ad acido metansolfonico (CH 4 oh 3 S, MSA) ha raggiunto sostanziale attenzione per l'abbondanza di entrambe le materie prime e per la capacità di una sua rapida integrazione nei processi chimici industriali esistenti. MSA è biodegradabile e non ossidante con potenziali applicazioni nel riciclaggio dei metalli, stoccaggio di energia e produzione di biodiesel. I precedenti lavori sulla metansolfonazione hanno sofferto di basse rese e conversioni, a causa della ricombinazione dei radicali liberi, con conseguenti prodotti collaterali indesiderati come etano, rendendo i metodi inadatti alla produzione su larga scala. tecnicamente, l'equilibrio tra reattività e selettività richiesto da un processo industriale può essere fornito dalla chimica dei superacidi. Díaz-Urrutia e Ott hanno riferito sul trattamento dell'oleum (dal 20 al 60% di triossido di zolfo) con CH 4 a circa 50 0 C utilizzando meno di 1 percentuale in moli dell'iniziatore elettrofilo per formare MSA con resa del 99 percento e selettività del 99 percento.
CH 4(g) + SO 3(l) → CH 3 COSÌ 3 h (l)
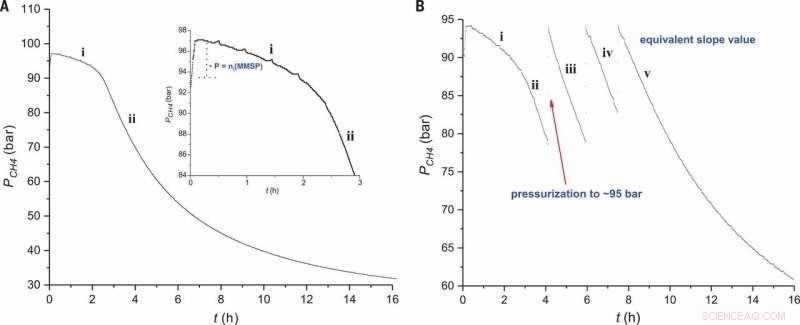
Profilo di reazione per metansolfonazione. La pressione di CH4 viene tracciata rispetto al tempo in condizioni standard (A) utilizzando l'iniziatore elettrofilo 0,9 moli % (Figura 2, voce 2) e (B) successive aggiunte di CH4 (Fig 2, ingresso 3). Il riquadro in (A) mostra una vista ingrandita della regione i. Credito:Scienza, doi:10.1126/science.aav0177.
Gli scienziati hanno prima studiato la reazione in un sistema batch per ottimizzare le condizioni sperimentali e ottenere ulteriori informazioni sul meccanismo di reazione. Per l'iniziatore elettrofilo, hanno utilizzato l'acido solforico monometilsulfonilperossido (MMSP) per migliorare la fattibilità tecnica. Per una maggiore produttività, hanno usato un reattore da quattro litri invece di un reattore da 400 ml, a causa di maggiori quantità di CH 4 formando nello spazio di testa del reattore più grande. Gli scienziati sono stati così in grado di mantenere quantità costanti di metano durante tutta la reazione per maggiori rese di MSA. Hanno usato una temperatura ottimale di 50 0 C per ottenere una selettività superiore al 99 percento verso MSA, considerando che i precedenti percorsi radicali avevano risultati simili a temperature più elevate (85 0 C) per decomposizione termica dell'iniziatore elettrofilo del perossido di solfonile. Gli esperimenti a bassa temperatura potrebbero anche offrire un'elevata conversione e selettività MSA, ma ha richiesto tempi di reazione più lunghi. Díaz-Urrutia e Ott hanno comparativamente fornito approfondimenti per supportare un meccanismo non radicale nel presente lavoro.
Quando gli scienziati hanno esaminato il profilo di reazione dell'esperimento, hanno osservato un periodo di induzione subito dopo l'aggiunta del reattore elettrofilo, dove la quantità di MSA (prodotto) era proporzionale alla quantità iniziale di MMSP (iniziatore). Nella fase due del profilo di reazione, hanno osservato la solubilità di CH 4 diminuisce con l'aumentare della pressione nel reattore. L'energia di attivazione del processo è stata determinata essere 111±1 kJ/mol, simili a quelli precedentemente segnalati. La via cationica descritta si è verificata in condizioni molto specifiche. I ricercatori hanno raggiunto un'elevata selettività attraverso cambiamenti elettronici nelle sostituzioni elettrofile, in contrasto con le reazioni di astrazione atomica basate sui radicali liberi precedentemente riportate.

Solfonazione del metano a MSA. (A) Schema del processo Díaz-Urrutia e Ott. La reazione procede in cascata attraverso reattori collegati in serie. L'impianto pilota potrebbe produrre fino a 20 tonnellate di MSA all'anno. L'eccesso di SO3 viene spento nel reattore Q, il flusso in eccesso di CH4 e il flusso del pozzetto MSA/H2SO4 vengono riciclati al reattore 1, e la miscela arricchita con MSA viene distillata nella colonna D per ottenere MSA puro. (B) La concentrazione di MSA aumenta mentre passa attraverso i reattori. (C) Reattore a finestra oblunga al quarzo con girante a gas, per una migliore miscelazione di CH4. Credito:Scienza, doi:10.1126/science.aav0177.
Poiché i risultati iniziali erano molto promettenti, gli scienziati hanno costruito un impianto pilota e testato la fattibilità economica e tecnica della produzione di MSA su scala industriale. Díaz-Urrutia e Ott hanno costruito l'impianto con una capacità prevista di 20 tonnellate/anno di produzione MSA, sulla base delle loro reazioni batch su scala di laboratorio, e ha tenuto conto della solubilità e del riciclaggio del metano, nonché per la concentrazione di anidride solforosa e metano. Questa configurazione ha permesso agli scienziati di aumentare costantemente la concentrazione di MSA mentre la miscela di reazione passava attraverso i reattori. Quando hanno utilizzato la gascromatografia con rilevamento a ionizzazione di fiamma (GC-FID) per monitorare i campioni, non hanno rilevato la presenza di alcani superiori nel flusso riciclato di metano o altri prodotti di ricombinazione radicale, consentendone l'utilizzo diretto come scorta di retroazione per la reazione a cascata.
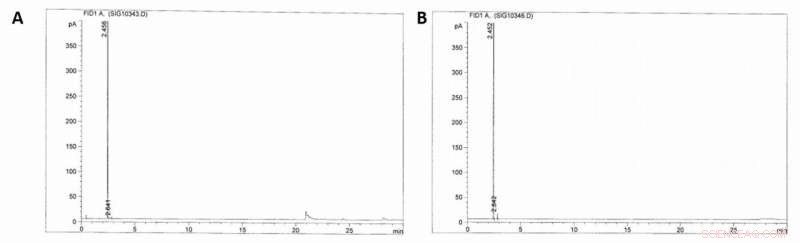
Cromatogrammi GC-FID. A) Cromatogramma GC-FID della fase gassosa del reattore (100 bar) prima che si sia verificata la solfonazione del metano. B) Cromatogramma GC-FID della fase gassosa dopo (~40 bar) avvenuta la solfonazione del metano (16 h, acido solforico fumante 36%, 500C). Credito:Scienza, doi:10.1126/science.aav0177.
Per permettersi l'MSA puro, Díaz-Urrutia e Ott hanno completato il processo con una fase finale di distillazione. Hanno quindi riciclato la restante miscela di acido solforico e MSA al primo reattore per la continua rigenerazione di anidride solforosa e acido solforico (SO 3 e H 2 COSÌ 4 ). Utilizzando le quattro camere di reazione del setup, gli scienziati sono stati in grado di produrre 200 kg di MSA puro a settimana, pari a due o tre tonnellate in 80 giorni. In questo modo, la dimostrata combinazione di elevata selettività, la conversione e l'economia atomica hanno reso il processo ideale per la valorizzazione su larga scala dei reagenti di metano e triossido di zolfo facilmente disponibili.
Se questo nuovo processo dell'acido metansolfonico avrà successo sul mercato, reagenti più economici potranno sostituire gli acidi minerali attualmente in uso. Però, anche se la produzione di MSA dovesse aumentare drasticamente, la quantità di metano consumata nel processo sarebbe ancora sminuita dalle quantità bruciate. Tuttavia, il lavoro di Díaz-Urrutia e Ott prevede un nuovo processo chimico sintetico per sintetizzare una sostanza chimica interessante, consentendo agli scienziati di immaginare una gamma di prodotti a valore aggiunto da derivare dal metano o da alcani superiori utilizzando questa via della chimica dei superacidi in futuro.
© 2019 Scienza X Rete