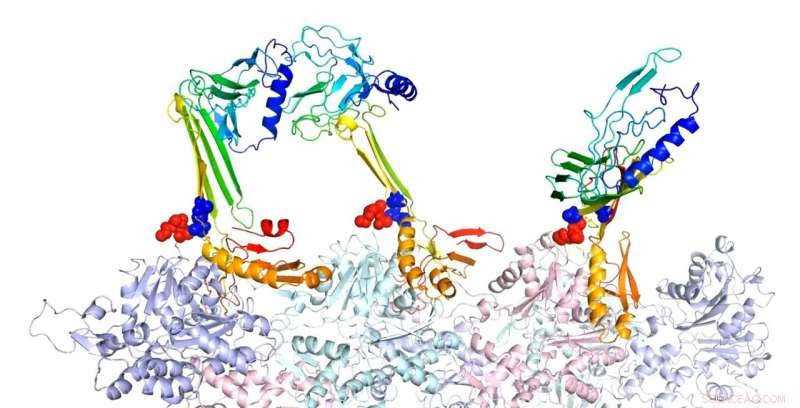
I ricercatori della Rice University hanno modellato le strutture di legame dell'actina e delle proteine associate che ritengono responsabili della formazione della memoria a lungo termine. Qui, la forma a forcina beta della sequenza cerniera è un potenziale nucleo per la formazione di fogli beta intramolecolari. Nella struttura complessa prevista di F-actina e tre costrutti PRD+ABD mostrati sopra, i tre costrutti PDB+ABD sono mostrati nei colori dell'arcobaleno, dal blu al rosso, dal terminale N al terminale C. Le superfici dei primi 4 residui negativi di monomeri di actina sono colorate in rosso e le superfici delle due estremità positive della sequenza della cerniera sono colorate in blu. Credito:Centro di Fisica Biologica Teorica/Rice University
Una proteina camaleontica nei neuroni può cambiare idea, e nel processo cambiamo il nostro cervello.
Scienziati della Rice University e dell'Università del Texas Health Science Center di Houston (UTHealth) hanno scoperto nuovi indizi nella proteina CPEB3 come parte della loro ostinata ricerca del meccanismo che consente agli esseri umani di avere ricordi a lungo termine.
Lo studio del biofisico teorico della Rice Peter Wolynes e Neal Waxham, un neurobiologo presso la McGovern Medical School di UTHealth, fornisce informazioni su un ciclo di feedback positivo tra la formazione delle spine dorsali di actina che conferiscono alle spine dendritiche la loro forma e flessibilità e i domini che legano l'actina in CPEB3, un prione funzionale che lega l'RNA che forma anche aggregati di lunga durata che possono effettivamente immagazzinare le cose di cui sono fatti i ricordi.
I modelli di ripiegamento delle proteine di Wolynes e del suo gruppo presso il Rice's Center for Theoretical Biological Physics (CTBP) e gli esperimenti presso UTHealth hanno rivelato dettagli strutturali precedentemente sconosciuti per CPEB3 e come si lega all'actina, come riportato in Atti dell'Accademia Nazionale delle Scienze carta.
Nel processo, hanno anche esaminato il ruolo chiave svolto da una proteina nota come SUMO, un regolatore che si attacca e si stacca da altre proteine nelle cellule per modificarne le funzioni. I ricercatori sospettano che aiuti a regolare quando e come le estremità camaleontiche di CPEB3 (il N-terminale e il C-terminale) si legano al SUMO o al flessibile, spine di actina filamentosa (f-actina) in punte dendritiche.
Le proteine CPEB3 sono solubili quando attaccate a SUMO, che seppellisce anche i loro siti che legano l'actina. Ma durante l'attività sinaptica, possono essere "deSUMOilati" e diventare disponibili per legarsi con le tasche di legame idrofobiche lungo i filamenti di f-actina.
I modelli mostrano che quando sono attratti dall'actina, CPEB3 passa da una bobina di eliche a spirale in una struttura a foglio beta che "si chiude" in una configurazione a forcina che gli consente di aggregarsi con altre proteine CPEB3.
All'atto dell'aggregazione, CPEB3 sembra tradurre i suoi RNA messaggeri bersaglio, che includono l'mRNA di actina che rafforza le giunzioni sinaptiche essenziali per la memoria, completando il ciclo positivo.
"Questo è un progetto più ambizioso dello studio actina-CaM chinasi, dove abbiamo anche simulato un sistema di actina davvero enorme con una proteina davvero enorme, " disse Wolynes. In quello studio, pubblicato un anno fa, I ricercatori CTBP hanno modellato come una proteina centrale (CaMKII) tiene insieme i filamenti di actina paralleli, uno stato che potrebbe essere visualizzato al microscopio elettronico dal laboratorio di Waxham.
Ora i ricercatori stanno definendo i dettagli strutturali che consentono a CPEB3 di legarsi all'actina o al SUMO, ma non entrambi. "Uno degli aspetti principali di questo articolo è conciliare queste due parti abbastanza diverse della storia, " ha detto. "Pensiamo che i terminali CPEB siano camaleontici perché consentono alla molecola di scegliere se interagire con il SUMO o con l'actina.
"Non siamo ancora alla fine della storia, " ha detto Wolynes. "Ma gli ultimi risultati ci mettono in una posizione ragionevole per dire di più sul meccanismo".