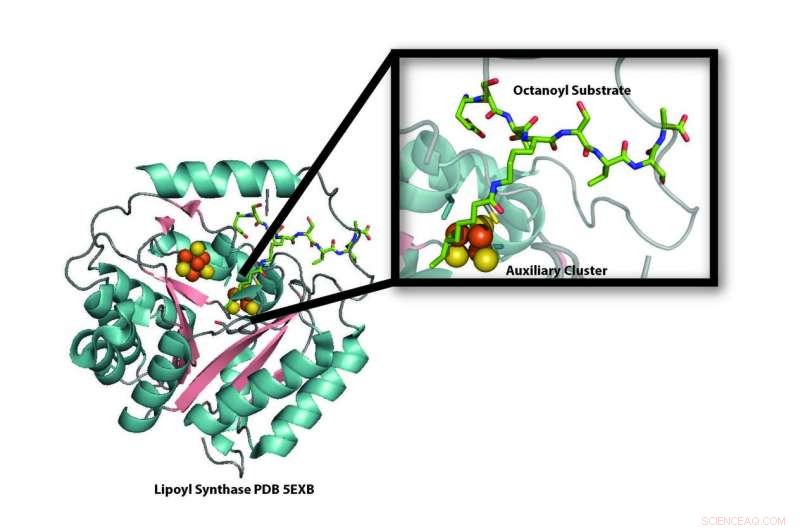
Modello della struttura cristallina dell'enzima lipoil sintasi (LipA) dal batterio Mycobacterium tuberculosis che rivela la distruzione di uno dei suoi cluster ferro-zolfo (palline arancioni e gialle) da utilizzare come fonte di zolfo per la produzione di acido lipoico. Una nuova ricerca dimostra che il cluster ferro-zolfo che viene distrutto durante la produzione di acido lipoico viene sostituito da una proteina trasportatrice ferro-zolfo, NfuA, in modo che LipA possa continuare a produrre acido lipoico. Crediti:Laboratorio Booker, Penn State University
Una nuova ricerca mostra come una proteina viene consumata e poi ricostituita durante la produzione di acido lipoico, un composto richiesto dai nostri corpi per convertire l'energia dal cibo in una forma che può essere utilizzata dalle nostre cellule. L'enzima lipoil sintasi (LipA) rimuove due atomi di idrogeno da una catena di carbonio inerte e li sostituisce con atomi di zolfo da uno dei suoi gruppi ferro-zolfo per creare acido lipoico, rendendosi inattivo nel processo. La nuova ricerca della Penn State University, che sarà pubblicato sulla rivista Scienza il 20 ottobre, 2017, mostra che un'altra proteina, un vettore di cluster ferro-zolfo chiamato NfuA, sostituisce il cluster ferro-zolfo distrutto in LipA, permettendogli di continuare a produrre acido lipoico. I risultati potrebbero anche aiutare gli scienziati a capire perché gli esseri umani con difetti nel gene vettore ferro-zolfo, una condizione fatale, hanno carenze di acido lipoico.
"LipA si cannibalizza per fornire gli atomi di zolfo necessari per la produzione di acido lipoico, " disse Squire Booker, professore di chimica e di biochimica e biologia molecolare alla Penn State University, un investigatore dell'Howard Hughes Medical Institute, e il corrispondente autore del documento di ricerca. "Quando lo abbiamo dimostrato nel 2011, era sconcertante perché se LipA viene distrutto, come potrebbe la cellula produrre abbastanza acido lipoico?"
LipA è un membro della famiglia di enzimi radicali SAM (S-adenosilmetionina). Come la maggior parte degli enzimi SAM radicali, contiene un gruppo di quattro atomi di ferro e quattro di zolfo, che usa per convertire SAM in un radicale ad alta energia. A sua volta, quel radicale può rimuovere gli atomi di idrogeno da altre molecole, un passaggio necessario per attivare molte importanti reazioni metaboliche cellulari. Gli atomi di idrogeno vengono sostituiti con zolfo per completare il processo.
Da dove provengono gli atomi di zolfo che LipA usa per produrre acido lipoico e come sono attaccati sono state le domande principali nel campo. Il modo in cui altri enzimi attaccano gli atomi di ossigeno ai centri di carbonio inerti è abbastanza ben compreso. In quei casi, ossigeno, che è ubiquitariamente disponibile nell'atmosfera, viene utilizzato per creare radicali ad alta energia ed è anche la fonte dell'atomo di ossigeno aggiunto. Zolfo, d'altra parte, non è ugualmente disponibile, ma a differenza della maggior parte degli altri enzimi SAM radicali, LipA ha un ulteriore cluster ferro-zolfo.
"Sapevamo da precedenti lavori che LipA utilizzava il suo secondo cluster ferro-zolfo come fonte di atomi di zolfo per creare acido lipoico, " ha detto Erin L. McCarthy, uno studente laureato nel laboratorio di Booker e il primo autore dell'articolo. "Ma questo ha creato un problema. Se LipA ha rubato atomi di zolfo dal suo stesso gruppo ferro-zolfo, l'enzima verrebbe distrutto e quindi non potrebbe creare più acido lipoico. Quando abbiamo appreso che gli esseri umani con geni NFU1 difettosi, l'equivalente umano del gene batterico NfuA utilizzato nei nostri esperimenti, aveva carenze di acido lipoico, abbiamo pensato che questo vettore ferro-zolfo potesse sostituire il cluster ferro-zolfo consumato in LipA, permettendogli di continuare a produrre acido lipoico."
Per verificare questa ipotesi, i ricercatori hanno eseguito due esperimenti chiave. Primo, hanno testato se LipA e NfuA si associano tra loro valutando la velocità con cui le molecole migrano attraverso un gel mediante una tecnica chiamata cromatografia di filtrazione su gel. In questa tecnica, le molecole grandi migrano più velocemente delle molecole più piccole. Quando LipA e NfuA sono stati combinati e quindi analizzati con questa tecnica, sono migrati più velocemente di quanto non facciano le due molecole da sole, suggerendo che le due molecole sono state legate insieme per formare un più grande, molecola a migrazione più rapida. I ricercatori hanno quindi creato una versione di NfuA che conteneva una forma leggermente diversa di atomi di zolfo (34S anziché 32S), una forma che potrebbero rintracciare se fosse incorporata nella LipA e poi nell'acido lipoico. In questo secondo esperimento, i ricercatori hanno dimostrato che dopo che il 32S originariamente presente in LipA è stato consumato nella reazione chimica per produrre acido lipoico, l'acido lipoico è stato prodotto contenente 34S, che poteva provenire solo dal loro NfuA ingegnerizzato.
"Siamo interessati da un po' di tempo sia al processo che aggiunge zolfo a un composto di carbonio inerte per produrre acido lipoico sia alla fonte dello zolfo aggiunto, " ha detto Booker. "L'acido lipoico è un componente vitale dei processi metabolici di base che mantengono vive le nostre cellule. Comprendere la reazione che lo crea non solo ci permette di capire meglio questo processo, ci dà anche informazioni su malattie umane come quella causata da mutazioni in NFU1 che provocano carenza di acido lipoico e morte".