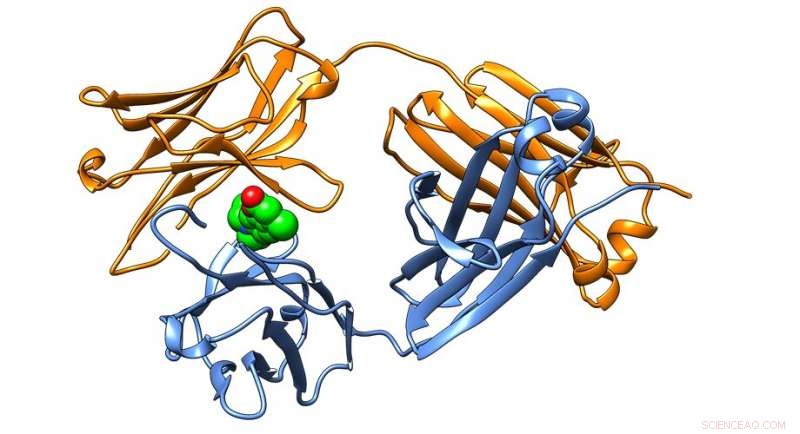
Struttura cristallina di una proteina anticorpale presente nelle amiloidosi a catena leggera, stabilizzato con successo da piccole molecole identificate nel Kelly Lab. Credito:The Scripps Research Institute
Gli scienziati di Scripps Research hanno identificato un gruppo di piccole molecole che prevengono i cambiamenti strutturali delle proteine che sono alla radice dell'amiloidosi AL, una malattia progressiva e spesso fatale.
Le piccole molecole si legano alle proteine delle immunoglobuline, che svolgono un ruolo essenziale nel sistema immunitario del corpo, e quindi stabilizzare le subunità della proteina chiamate catene leggere delle immunoglobuline. Il legame e la stabilizzazione delle catene leggere nella loro forma nativa impedisce loro di ripiegarsi male e formare le placche tossiche presenti nei pazienti con amiloidosi AL.
Etichettando le catene leggere con fluorofori e accoppiando i cambiamenti di forma alla scissione da parte della proteinasi K, quasi un milione di piccole molecole sono state esaminate per la loro capacità di prevenire i cambiamenti strutturali associati alla malattia utilizzando la polarizzazione della fluorescenza. Utilizzando questa strategia come base per uno schermo ad alto rendimento e vari controschermi distinti per eliminare gli artefatti, il team ha scoperto più farmaci candidati a piccole molecole che hanno impedito alle catene leggere di immunoglobuline di ripiegarsi male e aggregarsi in una provetta. L'approccio, se ha successo negli esseri umani, potrebbe cambiare il corso della malattia.
"Poiché abbiamo identificato il sito di legame delle piccole molecole delle catene leggere delle immunoglobuline che conferisce stabilizzazione mediante cristallografia, crediamo che questi risultati rappresentino un progetto per realizzare un farmaco tanto necessario per l'amiloidosi AL, " dice il professore di chimica di Scripps Research Jeffery Kelly, dottorato di ricerca, che ha condotto la ricerca. "Se possiamo bloccare l'aggregazione delle catene leggere appena secrete e impedire che vengano degradate in frammenti inclini all'aggregazione, speriamo di rallentare o addirittura arrestare la progressione della malattia, soprattutto per quei pazienti che mostrano un coinvolgimento cardiaco".
L'amiloidosi è una malattia rara e probabilmente sottodiagnosticata che assume molte forme. amiloidosi AL, chiamata anche amiloidosi delle catene leggere, è la seconda malattia amiloide sistemica più comune, con circa 4, 500 nuovi casi ogni anno negli Stati Uniti
Le plasmacellule delle persone con amiloidosi AL producono un componente di anticorpi noto come catene leggere di immunoglobuline, spesso invece degli anticorpi, a seguito di un cancro delle plasmacellule. Le catene leggere si piegano male e/o si raggruppano in piccole fibre che sono tossiche per gli organi. Col tempo, questi cosiddetti depositi di amiloide interferiscono progressivamente con la sana funzione del cuore, reni, fegato e altre parti del corpo.
Gareth Morgan di Scripps Research, dottorato di ricerca, autore principale dello studio, sottolinea che i pazienti affetti da AL con coinvolgimento di organi, in particolare coinvolgimento cardiaco, spesso sono troppo malati per tollerare la chemioterapia. La speranza è che gli stabilizzatori cinetici delle catene leggere delle immunoglobuline possano servire come primo trattamento per questi pazienti in modo che possano tollerare la chemioterapia.
I risultati del team di Scripps Research appaiono nel Atti dell'Accademia Nazionale delle Scienze . Oltre a descrivere il loro approccio di stabilizzazione cinetica per il trattamento dell'amiloidosi AL, i ricercatori affermano di immaginare un metodo semplice per identificare i pazienti che avrebbero maggiori probabilità di beneficiare del trattamento.
Kelly afferma che il meccanismo del farmaco identificato dal team è analogo a un altro farmaco che ha avuto origine anche presso Scripps Research:Tafamidis, che stabilizza la proteina transtiretina per trattare la più comune malattia amiloide sistemica che colpisce il cuore o altri organi. Kelly ha inventato i tafamidis insieme a Evan Powers, dottorato di ricerca, per il trattamento delle amiloidosi da transtiretina. Ora di proprietà di Pfizer, tafamidis è approvato in Europa con il nome Vyndaqel ed è stato recentemente presentato alla FDA per l'approvazione negli Stati Uniti.
Nicola Yan, uno studente laureato e co-primo autore dello studio, sta ora sviluppando stabilizzatori cinetici della catena leggera delle immunoglobuline più potenti e selettivi con proprietà simili a farmaci da utilizzare negli esseri umani, studi in corso in collaborazione con Reji Nair, dottorato di ricerca, un borsista post-dottorato, anche in collaborazione con altri a Scripps Research.