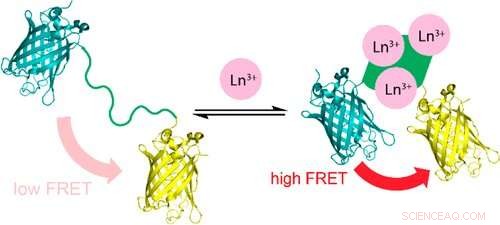
Un nuovo sensore cambia la sua fluorescenza quando si lega ai lantanidi (Ln), metalli delle terre rare utilizzati negli smartphone e in altre tecnologie, potenzialmente fornendo un modo più efficiente ed economico per rilevare questi metalli sfuggenti. Credito:Cotruvo Lab, Penn State
Un modo più efficiente ed economico per rilevare i lantanidi, i metalli delle terre rare utilizzati negli smartphone e in altre tecnologie, potrebbe essere possibile con un nuovo sensore a base di proteine che cambia la sua fluorescenza quando si lega a questi metalli. Un team di ricercatori di Penn State ha sviluppato il sensore da una proteina descritta di recente e successivamente lo ha utilizzato per esplorare la biologia dei batteri che utilizzano i lantanidi. Uno studio che descrive il sensore appare online nel Giornale della Società Chimica Americana .
"I lantanidi sono utilizzati in una varietà di tecnologie attuali, compresi gli schermi e l'elettronica degli smartphone, batterie delle auto elettriche, satelliti, e laser, " disse Giuseppe Cotruvo, Jr., assistente professore e Louis Martarano Career Development Professor di Chimica alla Penn State e autore senior dello studio. "Questi elementi sono chiamati terre rare, e includono elementi chimici di peso atomico da 57 a 71 sulla tavola periodica. Le terre rare sono difficili e costose da estrarre dall'ambiente o da campioni industriali, come le acque reflue delle miniere o i prodotti di scarto del carbone. Abbiamo sviluppato un sensore a base di proteine in grado di rilevare piccole quantità di lantanidi in un campione, facendoci sapere se vale la pena investire risorse per estrarre questi importanti metalli".
Il team di ricerca ha riprogettato un sensore fluorescente utilizzato per rilevare il calcio, sostituendo la parte del sensore che si lega al calcio con una proteina che hanno scoperto di recente che è diversi milioni di volte migliore nel legarsi ai lantanidi rispetto ad altri metalli. La proteina subisce un cambiamento di forma quando si lega ai lantanidi, che è la chiave per "accendere" la fluorescenza del sensore.
"Il gold standard per rilevare ogni elemento presente in un campione è una tecnica di spettrometria di massa chiamata ICP-MS, " disse Cotruvo. "Questa tecnica è molto sensibile, ma richiede una strumentazione specializzata che la maggior parte dei laboratori non ha, e non è economico. Il sensore a base di proteine che abbiamo sviluppato ci consente di rilevare la quantità totale di lantanidi in un campione. Non identifica ogni singolo elemento, ma può essere fatto rapidamente ed economicamente nel luogo del campionamento".
Il team di ricerca ha utilizzato il sensore anche per studiare la biologia di un tipo di batterio che utilizza i lantanidi, i batteri da cui è stata originariamente scoperta la proteina che si lega ai lantanidi. Studi precedenti avevano rilevato lantanidi nel periplasma dei batteri, uno spazio tra le membrane vicino all'esterno della cellula, ma, utilizzando il sensore, il team ha anche rilevato lantanidi nel citosol del batterio, il fluido che riempie la cellula.
"Abbiamo scoperto che il più leggero dei lantanidi, dal lantanio al neodimio sulla tavola periodica, entra nel citosol, ma quelli più pesanti no, " ha detto Cotruvo. "Stiamo ancora cercando di capire esattamente come e perché sia così, ma questo ci dice che ci sono proteine nel citosol che gestiscono i lantanidi, che prima non sapevamo. Capire cosa c'è dietro questa selettività ad alto assorbimento potrebbe anche essere utile nello sviluppo di nuovi metodi per separare un lantanide da un altro, che attualmente è un problema molto difficile."
Il team ha anche determinato che i batteri assorbono i lantanidi proprio come molti batteri assorbono il ferro; secernono piccole molecole che si legano strettamente al metallo, e l'intero complesso viene portato nella cella. Questo rivela che ci sono piccole molecole che probabilmente si legano ai lantanidi in modo ancora più stretto rispetto al sensore altamente selettivo.
"Speriamo di studiare ulteriormente queste piccole molecole e qualsiasi proteina nel citosol, che potrebbe finire per legarsi meglio ai lantanidi rispetto alla proteina che abbiamo usato nel sensore, " ha detto Cotruvo. "Indagare su come ciascuno di questi si leghi e interagisca con i lantanidi può darci ispirazione su come replicare questi processi quando si raccolgono i lantanidi per l'uso nelle tecnologie attuali".
Oltre a Cotruvo, il team di ricerca comprende Joseph Mattocks e Jackson Ho della Penn State.