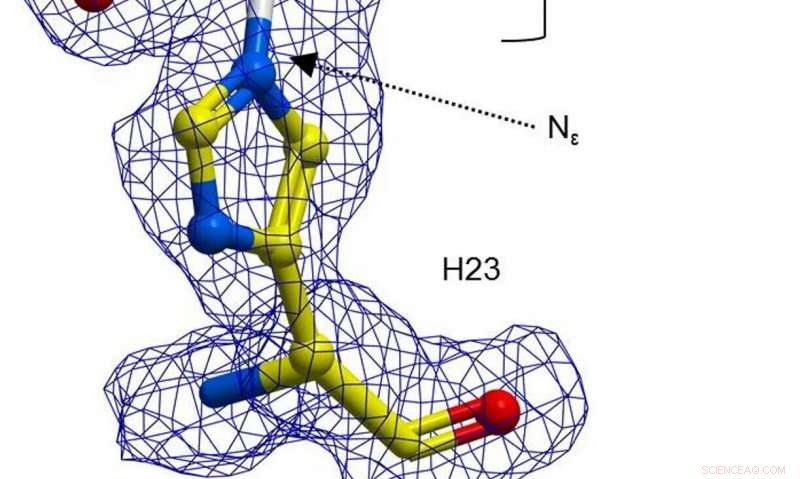
Una rappresentazione di H23 da BH32 inibita con 2-bromoacetofenone, colorato per tipo di atomo con atomi di carbonio H23 in giallo e atomi di carbonio acetofenone in bianco. Densità elettronica FEM chiara (blu, sagomato a 1σ) si estende tra il Nε di H23 e l'acetofenone. Credito: Natura (2019). DOI:10.1038/s41586-019-1262-8
Un team di chimici dell'Università di Manchester ha trovato un modo per incorporare un residuo anomalo in un enzima per mostrare come è possibile ampliare la gamma catalitica degli enzimi. Nel loro articolo pubblicato sulla rivista Natura , il gruppo descrive l'espansione della gamma di enzimi catalitici che potrebbero essere utilizzati per fornire una più ampia varietà di catene laterali per la catalisi, utilizzando un esteso "alfabeto" di amminoacidi. Adam Nelson, con l'Università di Leeds, ha pubblicato un articolo su News and Views Research che discute il lavoro del team nello stesso numero della rivista.
Come osserva Nelson, non ci sono molti residui di amminoacidi naturali che possono essere usati dagli enzimi per catalizzare le reazioni:osserva che ci sono solo 20 tipi che possono essere usati per costruire tali enzimi. Questa scarsità di opzioni ha portato i ricercatori a considerare se la gamma di amminoacidi che potrebbero essere utilizzati dagli enzimi per consentire reazioni più catalitiche potrebbe essere ampliata, forse utilizzando quello che i ricercatori descrivono come un "alfabeto" di amminoacidi che forniscono un più ampio varietà di catene laterali che possono essere utilizzate per la catalisi. In questo nuovo sforzo, i ricercatori hanno impiegato un alfabeto di amminoacidi così esteso per ampliare la gamma di possibilità. Riferiscono che così facendo, sono stati in grado di costruire un enzima utilizzando membri di un gruppo catalitico innaturale e hanno dimostrato che ciò potrebbe portare a miglioramenti utilizzando un approccio chiamato evoluzione diretta.
Nel loro lavoro, i ricercatori hanno deciso di rimodellare un enzima per renderlo un catalizzatore più efficace:hanno iniziato osservando che un residuo di amminoacido istidina nell'enzima BH32 può formare un composto acil-enzimatico intermedio. Quell'intermedio è stato idrolizzato per creare un prodotto dalla reazione, ma il risultato non è stato come previsto. Il team ha poi utilizzato l'evoluzione diretta per ottimizzare il ruolo della Nδ-metilistidina. Ciò ha comportato una serie di approcci per forzare le mutazioni. Di conseguenza, il team ha scoperto una variante chiamata OE1.3, che i test hanno dimostrato essere più efficiente. Il team ha proseguito con un'evoluzione più diretta e alla fine è arrivato all'OE1.4, un enzima che ha dimostrato una migliore attività catalitica.
© 2019 Scienza X Rete