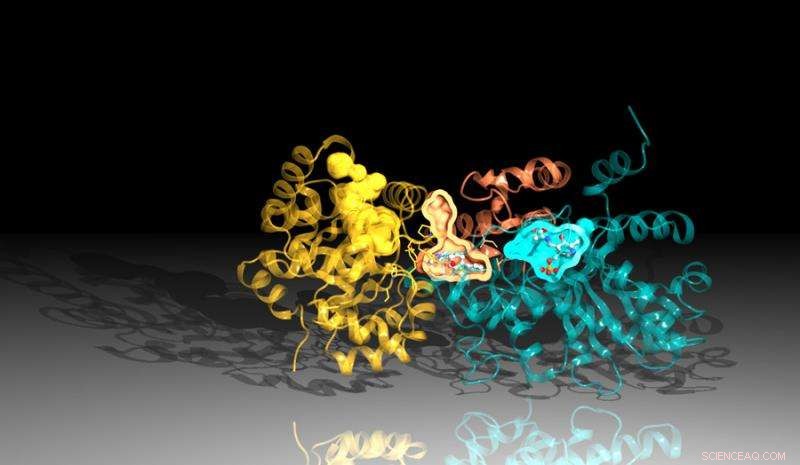
Immagine della proteina triptofano sintasi creata utilizzando i dati di diffrazione da Advanced Photon Source di Argonne. L'inibitore si lega tra i siti di reazione nella proteina, rappresentato qui dalle tasche arancioni e blu. Credito:Laboratorio nazionale Argonne
La tubercolosi ha ormai superato l'HIV in tutto il mondo come principale causa di morte per malattie infettive. I batteri che causano questa malattia, Mycobacterium tuberculosis (Mtb), sta sviluppando rapidamente una resistenza agli antibiotici attualmente disponibili, aumentando l'urgenza della scoperta di nuovi farmaci.
Gli scienziati dell'Argonne National Laboratory del Dipartimento dell'Energia degli Stati Uniti (DOE) facevano parte di una recente scoperta di una nuova molecola chiamata inibitore che attacca i batteri che causano la tubercolosi interrompendo la produzione di una sostanza chimica necessaria per la sua sopravvivenza.
La creazione di antibiotici comporta lo sviluppo di inibitori in grado di bloccare efficacemente i processi batterici essenziali. Altrettanto importante è continuare a trovare nuovi percorsi da indirizzare in modo che quando i batteri alla fine si adatteranno a resistere a un antibiotico, ci sono ancora altre strade disponibili da sfruttare.
Il nuovo studio, una collaborazione tra Argonne, l'Università di Chicago e il Broad Institute di Harvard e il MIT, identificato un inibitore che agisce bloccando l'azione di un'importante proteina nel Mtb. L'inibitore si lega a un canale all'interno della proteina che collega le sue due parti, uccidendo i batteri attraverso una svolta ironica. L'inibitore costringe una parte della proteina a produrre i componenti necessari per creare una sostanza chimica essenziale, triptofano, mentre allo stesso tempo rimodella il canale per intercettare quegli ingredienti prima che l'altra parte della proteina possa usarli.
Questi tipi di inibitori, chiamati inibitori allosterici, non si legano alla parte della proteina effettivamente responsabile della produzione della sostanza chimica bersaglio. Anziché, agiscono come una chiave inglese incastrata in altre parti meno ovvie del complicato macchinario dei batteri. L'inibitore identificato in questa ricerca, descritto in un recente articolo su Nature Chemical Biology, è oggi uno degli inibitori allosterici più studiati fino ad oggi.
La sostanza chimica mirata, triptofano, è una sostanza fondamentale per dare a tutte le cellule viventi la loro struttura e proteggerle dall'ambiente circostante. Le cellule umane devono frugare il triptofano dal cibo o dai batteri nell'intestino, ma le cellule Mtb possono produrre il proprio triptofano utilizzando una proteina complessa chiamata triptofano sintasi. "Sapevamo che un modo per uccidere questi batteri era trovare un modo per bloccare la triptofano sintasi, "ha detto Karolina Michalska, un cristallografo delle Argonne e autore dello studio.
Prima che iniziasse la collaborazione, un gruppo di scienziati del Broad Institute ha messo una piccola quantità di batteri in piastre di Petri e ha posizionato diversi potenziali inibitori in ciascuna di esse. Su una libreria di oltre 80, 000 potenziali inibitori testati, solo pochi hanno ucciso la Mtb. Gli scienziati sospettavano che uno di questi inibitori spegnesse la triptofano sintasi della Mtb, ma avevano bisogno di vedere cosa stava succedendo a livello molecolare.
Gli scienziati di Argonne hanno sentito parlare del lavoro al Broad Institute, ei due gruppi iniziarono a collaborare. Argonne ha prodotto triptofano sintasi per il Broad Institute da utilizzare per testare l'inibitore. Hanno anche determinato la struttura della sintasi con l'inibitore ad essa legato esponendo i cristalli composti dal complesso proteina-inibitore a raggi X ad alta energia dall'Advanced Photon Source (APS) di Argonne e registrando come gli elettroni nella molecola diffondono la luce .
"La collaborazione ci ha permesso di determinare la natura allosterica dell'inibitore e le sfumature di come funzionava l'inibizione, " disse Deborah Hung, professore alla Harvard Medical School e co-direttore del Programma Malattie Infettive e Microbioma presso il Broad Institute.
L'analisi strutturale ha determinato che ci sono due parti chiave che compongono la triptofano sintasi. Quando una delle regioni segnala all'altra che è pronta, l'altra regione produce una sostanza chimica chiamata indolo. L'indolo quindi viaggia attraverso un canale verso l'altra regione della triptofano sintasi dove si combina con un'altra sostanza per creare il prodotto finale, triptofano.
Una leggera instabilità nel canale consentirebbe all'indolo di viaggiare dall'altra parte, ma l'inibitore è sagomato in modo da stabilizzare il canale, impedendo all'indolo di muoversi. Poiché l'indolo non può raggiungere il lato opposto della proteina, l'inibitore blocca la produzione di triptofano.
"In realtà funziona in modo piuttosto subdolo, " ha detto Andrzej Joachimiak, Direttore dell'Argonne's Structural Biology Center e del Midwest Center for Structural Genomics. "L'inibitore costringe la triptofano sintasi a produrre l'indolo e gli impedisce di svolgere il suo compito finale".
Sebbene i ricercatori siano ottimisti sul potenziale di questo inibitore come antibiotico, è ancora lontano dall'essere un farmaco disponibile. Hanno studiato come reagirebbe il tessuto umano alla molecola e hanno confermato che non è tossico, ma gli esperimenti sui topi hanno dimostrato che l'inibitore sarebbe metabolizzato dall'organismo troppo rapidamente. Attualmente sono in corso ricerche per perfezionare la struttura dell'inibitore in modo che persista nel flusso sanguigno per un lungo periodo di tempo.