
Istantanee di una simulazione che rivela il meccanismo mediante il quale l'elicasi del virus dell'epatite C rompe i doppi filamenti di DNA. I due domini motori camminano lungo il filamento superiore utilizzando il meccanismo di traslocazione del verme. Il terzo dominio agisce come un cuneo che separa meccanicamente il duplex (da Fig. 14). Credito:Università di Kanazawa
La cellula vivente può essere vista come una fabbrica in cui le macchine proteiche sono responsabili di vari processi, come il trasporto di materiale all'interno della cellula o le operazioni con altre macromolecole come il DNA. Il loro funzionamento è tipicamente alimentato da molecole di ATP, il principale vettore energetico nelle cellule biologiche. L'energia chimica ottenuta attraverso l'idrolisi dell'ATP viene utilizzata da una macchina proteica per cambiare ciclicamente la sua forma e quindi per svolgere una particolare funzione. Quindi, risolvere i cambiamenti conformazionali funzionali nelle proteine è una sfida importante, di fondamentale importanza per la comprensione e il controllo di motori e macchine biologiche a singola molecola.
La complessità delle interazioni tra gli atomi in una macchina proteica è così elevata che anche i migliori supercomputer del mondo non sono in grado di riprodurre solo uno dei loro cicli operativi. In questo articolo di recensione, è tuttavia dimostrato che aspetti essenziali del funzionamento di tali nano-dispositivi naturali possono essere già rivelati esplorando modelli meccanici di proteine molto semplici, cioè trattando tali macromolecole come reti elastiche ottenute collegando particelle con un insieme di molle elastiche.
Gli autori, il professor Alexander Mikhailov e l'assistente professore Holger Flechsig del Nano Life Science Institute dell'Università di Kanazawa in Giappone, sostengono che le reti elastiche corrispondenti a macchine proteiche con dinamica funzionale hanno proprietà speciali, emerse nel corso dell'evoluzione biologica. Nonostante un'apparente complessità, i moti interni in tali sistemi procedono in modo ordinato, come guidati lungo binari nascosti. Così, una macchina molecolare si comporta in modo simile a dispositivi meccanici macroscopici con movimenti altamente coordinati delle loro parti. Ciò garantisce che la fabbrica cellulare possa funzionare in modo robusto nonostante le forti fluttuazioni presenti su scala nanometrica.
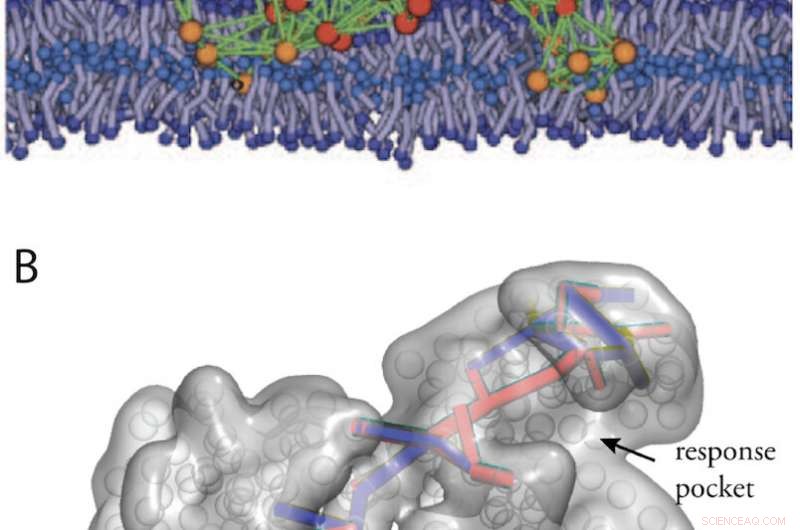
Strutture artificiali simili a proteine ottenute da in-silico Evoluzione. (A) Un modello di macchina proteica in una membrana biologica (da Fig. 11). (B) Percorsi di comunicazione in una struttura allosterica progettata (dal Rif. 34). Credito:Università di Kanazawa
Utilizzando questo approccio, è stato possibile eseguire simulazioni che coprono interi cicli operativi e sono stati così ottenuti i primi film molecolari di macchine proteiche. Come esempio, La Fig.1 della pubblicazione originale del 2010 degli autori mostra come la proteina motore dell'elicasi del virus dell'epatite C, una parte principale del suo meccanismo di replicazione e un importante bersaglio farmacologico per i farmaci antivirali, si muova attivamente lungo il DNA e lo decomprima meccanicamente.
Strutture artificiali simili a proteine con proprietà di macchine potrebbero inoltre essere progettate eseguendo un'evoluzione computerizzata delle reti elastiche. In Fig. 2 sono mostrati due esempi, una macchina modello progettata che opera all'interno di una membrana biologica, e una macchina che esibisce la comunicazione allosterica.
Questo articolo di revisione presenta una nuova prospettiva nella comprensione del complesso meccanismo delle cellule biologiche. Inoltre apre la strada a nuovi approcci nella progettazione di nanomacchine artificiali, un compito di grande potenziale per future applicazioni biotecnologiche.