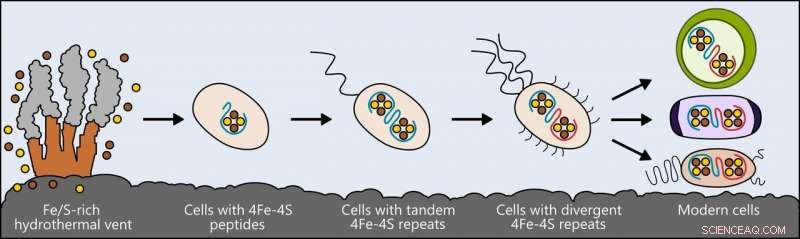
La vita potrebbe essere sorta vicino a bocche idrotermali ricche di ferro e zolfo. Le prime cellule incorporavano questi elementi in piccoli peptidi, che divennero le prime e più semplici ferredossine, proteine che trasportano gli elettroni all'interno della cellula, per supportare il metabolismo. Man mano che le cellule si evolvevano, ferredossine mutate in forme più complesse. Le ferredossine nei batteri moderni, le cellule vegetali e animali sono tutte derivate da quel semplice antenato. Credito:Ian Campbell, Università del riso
Uno studio condotto da Rutgers fa luce su uno dei misteri più duraturi della scienza:come è iniziato il metabolismo, il processo attraverso il quale la vita si alimenta convertendo l'energia dal cibo in movimento e crescita?
Per rispondere a questa domanda, i ricercatori hanno decodificato una proteina primordiale e l'hanno inserita in un batterio vivente, dove ha alimentato con successo il metabolismo cellulare, crescita e riproduzione, secondo lo studio in Atti dell'Accademia Nazionale delle Scienze .
"Siamo più vicini alla comprensione del funzionamento interno dell'antica cellula che era l'antenata di tutta la vita sulla terra e, perciò, per capire come è nata la vita in primo luogo, e i percorsi che la vita avrebbe potuto prendere su altri mondi, " ha detto l'autore principale Andrew Mutter, un associato post-dottorato presso il Dipartimento di Scienze Marine e Costiere della Rutgers University.
La scoperta ha implicazioni anche per il campo della biologia sintetica, che sfrutta il metabolismo dei microbi per produrre prodotti chimici industriali; e bioelettronica, che cerca di applicare i circuiti naturali delle cellule per l'accumulo di energia e altre funzioni.
I ricercatori hanno esaminato una classe di proteine chiamate ferredossine, che supportano il metabolismo nei batteri, piante e animali spostando l'elettricità attraverso le cellule. Queste proteine hanno differenti forme complesse negli esseri viventi di oggi, ma i ricercatori ipotizzano che derivino tutti da una proteina molto più semplice che era presente nell'antenato di tutta la vita.
Simile ai modi in cui i biologi confrontano uccelli e rettili moderni per trarre conclusioni sul loro antenato comune, i ricercatori hanno confrontato le molecole di ferredossina presenti negli esseri viventi e, utilizzando modelli informatici, forme ancestrali progettate che potrebbero essere esistite in una fase precedente nell'evoluzione della vita.
Quella ricerca ha portato alla creazione di una versione base della proteina, una semplice ferredossina in grado di condurre elettricità all'interno di una cellula e che, per eoni di evoluzione, avrebbe potuto dare origine ai tanti tipi che esistono oggi.
Quindi, per dimostrare che il loro modello dell'antica proteina potrebbe effettivamente supportare la vita, lo hanno inserito in una cellula vivente. Hanno preso il genoma di batteri E. coli, rimosso il gene che utilizza per creare la ferredossina in natura, e impiombati in un gene per la loro proteina decodificata. La colonia modificata di E. coli è sopravvissuta ed è cresciuta anche se più lentamente del normale.
Il coautore dello studio Vikas Nanda, professore presso la Rutgers Robert Wood Johnson Medical School e Center for Advanced Biotechnology and Medicine, ha affermato che le implicazioni della scoperta per la biologia sintetica e la bioelettronica derivano dal ruolo delle ferredossine nei circuiti della vita.
"Queste proteine incanalano l'elettricità come parte dei circuiti interni di una cellula. Le ferredossine che compaiono nella vita moderna sono complesse, ma abbiamo creato una versione ridotta che supporta ancora la vita. Esperimenti futuri potrebbero basarsi su questa versione semplice per possibili applicazioni industriali , "ha detto Nanda.