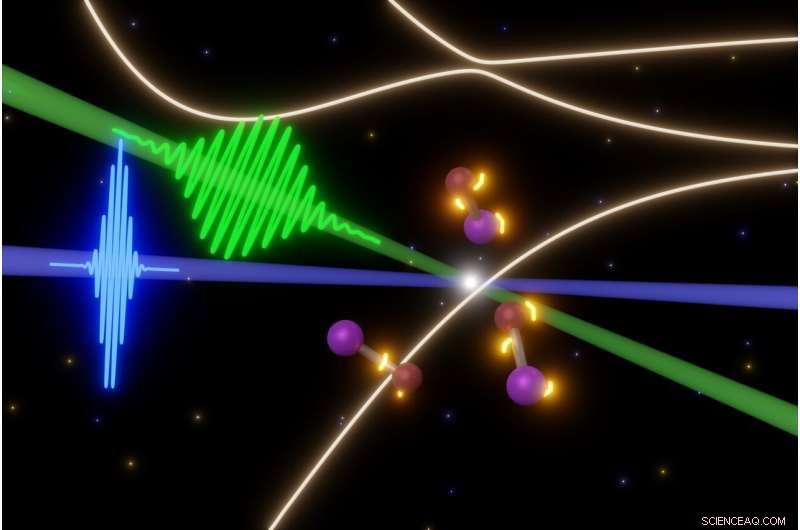
Gli scienziati dell'Università di Berkeley stanno sondando le fasi fugaci delle rapide reazioni fotochimiche con alcuni degli impulsi laser più brevi possibili oggi. In questo caso, un impulso di femtosecondi di luce visibile (verde) innesca la rottura delle molecole di iodio monobromuro (al centro), mentre gli impulsi laser XUV ad attosecondi (blu) scattano istantanee delle molecole. Ciò consente loro di realizzare un film dell'evoluzione degli stati elettronici (luci gialle attorno alle molecole) prima che le molecole si dissolvano. Credito:Yuki Kobayashi, UC Berkeley
Nelle luminose giornate estive, la luce del sole intorno a noi si sta rompendo rompendo i legami. Legami chimici.
La luce ultravioletta rompe i legami tra gli atomi nel DNA delle nostre cellule della pelle, potenzialmente causa di cancro. La luce UV rompe anche i legami di ossigeno, eventualmente creando ozono, e scinde l'idrogeno da altre molecole per lasciare i radicali liberi che possono danneggiare i tessuti.
Università della California, Berkeley, i chimici che utilizzano alcuni degli impulsi laser più brevi disponibili, un quintilionesimo di secondo, sono ora in grado di risolvere il processo passo dopo passo che porta all'esplosione di un legame chimico, essenzialmente facendo un film dell'evento. Possono seguire gli elettroni che rimbalzano indecisi in vari stati nella molecola prima che il legame si rompa, e gli atomi prendono strade separate.
La tecnica, riportato la scorsa settimana sul giornale Scienza , aiuterà i chimici a comprendere e potenzialmente manipolare le reazioni chimiche stimolate dalla luce, cosiddette reazioni fotochimiche. Chimici e biologi, in particolare, sono interessati a capire come le grandi molecole riescano ad assorbire l'energia luminosa senza rompere alcun legame, come accade quando le molecole nell'occhio assorbono la luce, dandoci visione, o le molecole nelle piante assorbono la luce per la fotosintesi.
"Pensa a una molecola, rodopsina, negli occhi, " ha detto il primo autore Yuki Kobayashi, uno studente di dottorato dell'Università di Berkeley. "Quando la luce colpisce la retina, la rodopsina assorbe la luce visibile, e possiamo vedere le cose perché la conformazione del legame della rodopsina cambia".
Infatti, quando l'energia luminosa viene assorbita, un legame in torsioni di rodopsina, invece di pause, innescando altre reazioni che determinano la percezione della luce. La tecnica Kobayashi e i suoi colleghi dell'UC Berkeley, professori Stephen Leone e Daniel Neumark, sviluppato potrebbe essere utilizzato per studiare in dettaglio come questo assorbimento della luce porta alla torsione dopo che la molecola passa attraverso uno stato eccitato chiamato incrocio evitato o intersezione conica.
Per prevenire la rottura di un legame nel DNA, "vuoi reindirizzare l'energia dalla dissociazione al solo essere vibrazionalmente caldo. Per la rodopsina, vuoi reindirizzare l'energia dalla vibrazione a un'isomerizzazione cis-trans, una svolta, " ha detto Kobayashi. "Questi reindirizzamenti delle reazioni chimiche stanno accadendo ovunque intorno a noi, ma non abbiamo mai visto il momento reale di loro prima."

Yuki Kobayashi apporta modifiche a un esperimento nel seminterrato di Hildebrand Hall. Lui e i ricercatori nei laboratori di Stephen Leone e Daniel Neumark prendono di mira le molecole in una camera a vuoto con laser a femtosecondi e ad attosecondi per scoprire come le molecole assorbono la luce. Credito:UC Berkeley foto per gentile concessione di Robert Sanders
Impulsi laser veloci
I laser ad attosecondi (un attosecondo è un miliardesimo di miliardesimo di secondo) esistono da circa un decennio e vengono utilizzati dagli scienziati per sondare reazioni molto veloci. Poiché la maggior parte delle reazioni chimiche avviene rapidamente, questi laser a impulsi veloci sono la chiave per "vedere" come si comportano gli elettroni che formano il legame chimico quando il legame si rompe e/o si riforma.
Leone, professore di chimica e di fisica, è uno sperimentatore che utilizza anche strumenti teorici ed è un pioniere nell'uso di laser ad attosecondi per sondare reazioni chimiche. Ha sei di questi raggi X e ultravioletti estremi (collettivamente, XUV) nel suo laboratorio dell'Università di Berkeley.
Lavorando con una delle molecole più semplici, monobromuro di iodio (IBr), che è un atomo di iodio collegato a un atomo di bromo, il team dell'UC Berkeley ha colpito le molecole con un impulso di luce visibile di 8 femtosecondi per eccitare uno dei loro elettroni più esterni, poi li ha sondati con impulsi laser ad attosecondi.
Pulsare il laser XUV ad attosecondi a intervalli di 1,5 femtosecondi (un femtosecondo è 1, 000 attosecondi), proprio come usare una luce stroboscopica, i ricercatori potrebbero rilevare i passaggi che portano alla rottura delle molecole. Il laser XUV ad alta energia è stato in grado di esplorare gli stati energetici eccitati relativi agli elettroni interni della molecola, che normalmente non partecipano alle reazioni chimiche.
"Stai facendo un film sui percorsi dell'elettrone quando si avvicina all'incrocio e sulla probabilità che vada lungo un percorso o lungo un altro, " disse Leone. "Questi strumenti che stiamo sviluppando ti permettono di guardare i solidi, gas e liquidi, ma sono necessarie scale temporali più brevi (fornite da un laser ad attosecondi). Altrimenti, vedi solo l'inizio e la fine, e non sai cos'altro è successo nel mezzo."
L'esperimento ha mostrato chiaramente che gli elettroni esterni di IBr, una volta eccitato, vedere improvvisamente una varietà di stati o luoghi in cui potrebbero essere ed esplorarne molti prima di decidere quale strada prendere. In questa semplice molecola, però, tutti i percorsi portano all'elettrone che si deposita su iodio o bromo e i due atomi si allontanano.
Nelle molecole più grandi, che il team spera presto di esplorare, gli elettroni eccitati avrebbero più scelte, alcuni dove l'energia va in una svolta, come con la rodopsina, o in vibrazione molecolare senza che le molecole si rompano.
"In biologia, si scopre che l'evoluzione ha selezionato cose che sono estremamente efficaci nell'assorbire l'energia e non rompere un legame, " disse Leone. "Quando qualcosa va storto nella tua chimica è quando vedi le malattie spuntare."