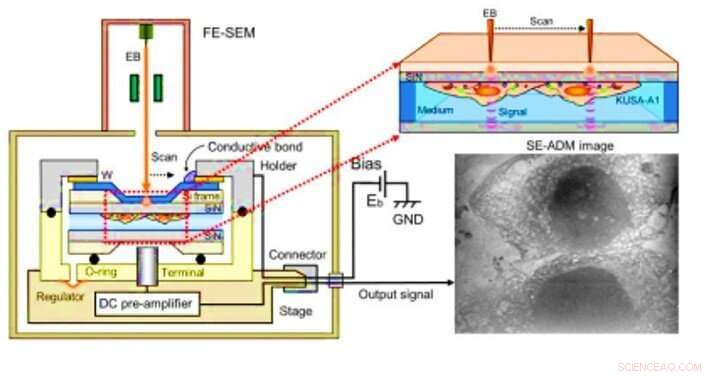
Osservazione mediante microscopia dielettrica elettronicamente assistita (SE-ADM) di osteoblasti. (A) SE-ADM ad alta risoluzione impostato per l'osservazione degli osteoblasti. Il supporto per campioni liquidi, inclusi gli osteoblasti, è montato sul palco collegato al preamplificatore, che viene introdotto nella camera SEM del campione. Il fascio di elettroni di scansione viene applicato al film SiN rivestito con W a una bassa tensione di accelerazione. Il terminale di misurazione sotto il supporto rileva i segnali elettrici attraverso i campioni liquidi. Sono visibili strutture intracellulari chiare (immagine a destra). Credito:progressi scientifici, doi:10.1126/sciadv.aax0672
La mineralizzazione è mediata dagli osteoblasti, che secernono precursori minerali attraverso le vescicole della matrice (MV) come processo fondamentale nei vertebrati. Le vescicole sono ricche di calcio e fosfato, contenenti materiali organici come proteine acide. In un nuovo studio ora pubblicato in Progressi scientifici , Tomoaki Iwayama e colleghi dei dipartimenti di parodontologia, ricerca biomedica, scienza orale, i biomateriali e lo sviluppo dell'anatomia orale hanno utilizzato la microscopia dielettrica assistita da elettroni (SE-ADM) e la microscopia a super-risoluzione (SRM) per valutare gli osteoblasti vivi durante condizioni di mineralizzazione a risoluzione nanometrica. Hanno scoperto che le vescicole contenenti calcio sono corpi multi-vescicolari contenenti nanovescicole mineralizzanti o vescicole di matrice (MV). Secondo le osservazioni, i MV potrebbero essere trasportati insieme ai lisosomi e secreti per esocitosi. Iwayama et al. hanno presentato la prova che i lisosomi potrebbero trasportare fosfato di calcio amorfo nelle cellule degli osteoblasti mineralizzanti.
Durante il fisiologico processo di mineralizzazione ossea, la deposizione di cristalli di fosfato di calcio avviene nella matrice extracellulare come processo fondamentale in tutti i vertebrati. Nel 1967, i biologi Clarke Anderson ed Ermanno Bonucci, particelle correlate ai minerali visualizzate individualmente nello spazio extracellulare mediante microscopia elettronica (EM). Gli scienziati hanno successivamente riconosciuto queste particelle come nano-vescicole mineralizzanti o vescicole di matrice (MV). Durante gli ultimi 50 anni di studi EM sulle MV, i biologi hanno cercato di capire il meccanismo di formazione e secrezione di MV, che rimane in gran parte sconosciuto.
Chiarire il processo di mineralizzazione delle cellule vive con EM è impegnativo poiché la preparazione del campione per EM richiede passaggi sia sulla fissazione chimica che sulla disidratazione alcolica. I passaggi possono indurre artefatti e persino dissolvere o rimuovere precursori minerali instabili lasciando un'impalcatura organica nota come "fantasma di cristallo". Mentre gli scienziati avevano utilizzato con successo il processo di EM utilizzando tessuto fisso e disidratato per visualizzare la struttura delle fibrille di collagene mineralizzate nell'osso, studiare i precursori minerali, devono impiegare processi crio-EM per evitare la disidratazione e facilitare costosi, raffreddamento estremamente rapido con campioni di piccole dimensioni.
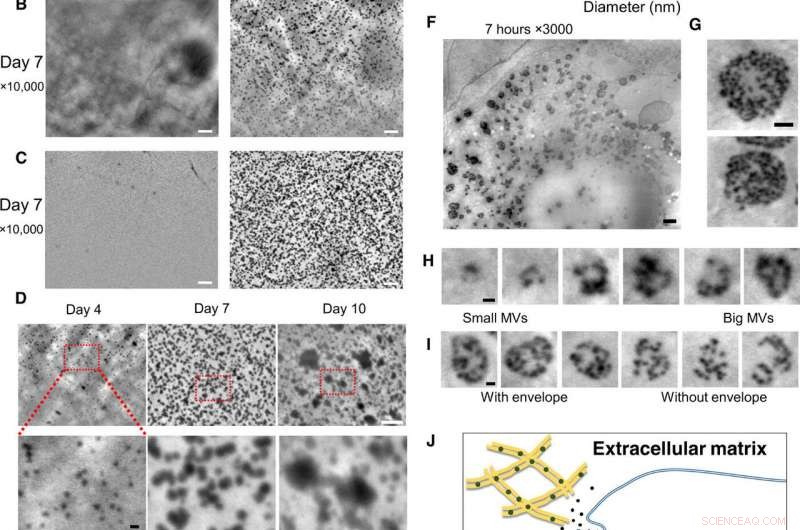
Osservazione su nanoscala di osteoblasti vivi nei terreni di coltura, utilizzando il sistema SE-ADM. (A) Immagini SE-ADM rappresentative ad alta risoluzione di osteoblasti coltivati con o senza mezzi osteogenici per 2 giorni. Le particelle nere erano evidenti solo quando coltivate in terreni osteogenici (a destra, quadrato in basso). (B) Immagini SE-ADM rappresentative ad alta risoluzione di osteoblasti coltivati con o senza mezzi osteogenici per 7 giorni. Ci sono molte particelle nere quando coltivate in terreni osteogenici (a destra). (C) Immagini SE-ADM rappresentative ad alta risoluzione del film SiN dopo la rimozione delle cellule. Nei media normali, non si osservano particelle (a sinistra). L'immagine del film dopo la rimozione delle cellule coltivate in terreno osteogenico mostra molte particelle nere chiare disperse in tutta l'area (a destra). (D) Confronto di immagini di particelle durante 4-10 giorni di coltura in mezzi osteogenici. Le dimensioni delle particelle sono gradualmente aumentate. (E) Distribuzione della dimensione delle particelle misurata durante 4-10 giorni di coltura in mezzi osteogenici. Sono state misurate e tracciate come istogramma da circa 900 a 1100 particelle per punto temporale. (F) Immagini SE-ADM rappresentative ad alta risoluzione di osteoblasti coltivati con mezzi osteogenici per 7 ore. (G) Gli MVB hanno buste grigie trasparenti. (H) Taglia immagini di varie dimensioni MVB, comprese le particelle. (I) Confronto di MVB con o senza busta grigia. (J) Vista schematica della formazione intracellulare e del trasporto di MVB negli osteoblasti mineralizzanti. Barre della scala, 1 um da (A) a (C) e (F); 500 nm in (G); 200 nm pollici (D, parte inferiore), (H), e io). Credito:progressi scientifici, doi:10.1126/sciadv.aax0672
Per superare queste limitazioni nel presente lavoro, Iwayama et al. ha utilizzato un nuovo sistema microscopico noto come microscopia dielettrica a scansione elettronica assistita (SE-ADM). Il metodo aveva precedentemente ottenuto una risoluzione su scala nanometrica e immagini ad alto contrasto per le cellule di mammifero in mezzi acquosi senza colorazione. Gli scienziati hanno utilizzato la stessa tecnica (SE-ADM ad alta risoluzione) per esplorare la possibilità di visualizzare MV in osteoblasti intatti per comprendere la biogenesi del traffico di MV. Per la linea cellulare degli osteoblasti hanno utilizzato la linea cellulare osteoblastica murina (topo) KUSA-A1, con elevata capacità osteogenica in vitro e in vivo. Dopo la coltura cellulare in condizioni adeguate, Iwayama et al. osservato le cellule con SE-ADM per identificare le normali strutture intracellulari. Gli scienziati hanno osservato che le MV si allineano con le fibrille di collagene dopo 4-10 giorni di crescita cellulare nei mezzi osteogenici e la dimensione delle particelle secrete è aumentata a causa della fusione o della crescita delle particelle, con le loro dimensioni coerenti con i rapporti precedenti per suggerire che fossero effettivamente MV.
Dopo un ulteriore esame con SE-ADM, hanno notato il coinvolgimento della via lisosomiale per trasportare e secernere MV intraluminali in un processo simile agli esosomi. interessante, sia gli esosomi che i MV sono classificati come vescicole extracellulari con dimensioni simili; sono entrambi secreti dagli osteoblasti e hanno funzioni condivise durante la comunicazione cellula-cellula.

Caratterizzazione di vescicole contenenti minerali. (A e B) Immagini di particelle ad alta risoluzione prima (A) e dopo (B) la rimozione delle cellule coltivate in terreni osteogenici per 7 giorni. Le mappe pseudocolori delle immagini delle particelle ingrandite indicate dalle frecce rosse sono mostrate sul lato destro di (B). Le particelle mostrano strutture molto lisce senza cristalli. (C) Immagini di microscopia elettronica a scansione (SEM) e analisi spettrometrica EDX di particelle su un film di SiN. L'immagine SEM sul lato sinistro mostra il film SiN dopo la rimozione delle cellule coltivate in terreni normali, che non mostra particelle, e i dati spettrometrici EDX non mostrano picchi di fosforo e calcio. In contrasto, l'immagine SEM e i dati spettrometrici EDX sul lato destro mostrano particelle e picchi acuti di fosforo e calcio dopo la coltura in terreni osteogenici. (D) Analisi di elementi particellari mediante mappe spettrometriche EDX. Le particelle contenevano fosforo, calcio, carbonio, e azoto. (E) Spettri Raman ottenuti da osteoblasti coltivati con o senza mezzi osteogenici per 23 giorni. Un picco acuto di 960 cm-1 era evidente solo nei mezzi osteogenici (lato destro). a.u., unità arbitrarie. (F) Confronto di immagini SE-ADM di osteoblasti knockout (KO) Alpl in mezzi normali e osteogenici. Le particelle sono completamente scomparse nei mezzi osteogenici. (G) Spettro EDX di particelle da osteoblasti Alpl KO su un film di SiN. I dati spettrometrici EDX sul lato sinistro mostrano il film SiN dopo la rimozione delle cellule coltivate in terreni normali, che non mostrano picchi di fosforo e calcio. Inoltre, le particelle nei mezzi osteogenici dei dati del lato destro non mostrano picchi di fosforo e calcio. Barre della scala, 1 micron in (A), (C, superiore), (D), e (F); 200 nm in (B); 100 nm pollici (B, Giusto). Credito:progressi scientifici, doi:10.1126/sciadv.aax0672
Nel passaggio successivo, Iwayama et al. esaminato se queste particelle fossero MV contenenti calcio e/o fosfato. Per questo, hanno coltivato le cellule in mezzi osteogenici per 7 giorni e le hanno osservate utilizzando SE-ADM per registrare strutture molto lisce senza sfaccettature cristalline. Ciò ha suggerito che le MV non si sono cristallizzate ma sono rimaste amorfe come registrato anche in uno studio precedente. Quando gli scienziati hanno esaminato le MV su un film di SiN (mononitruro di silicio), hanno osservato picchi acuti corrispondenti al fosforo, calcio, elementi di carbonio e ossigeno. Hanno confermato i risultati utilizzando la spettroscopia Raman per mostrare la presenza di fosfato di calcio all'interno delle MV.
Gli scienziati hanno anche studiato gli effetti dell'ipofosfatasia, una condizione medica codificata dal Gene Alpl (fosfatasi alcalina) , in cui gli osteoblasti non subiscono mineralizzazione in vitro. Per questo, hanno modificato il genoma delle cellule degli osteoblasti utilizzando la tecnologia di modifica del genoma CRISPR-Cas9 per generare cloni di osteoblasti knockout Alpl. Quando Iwayama et al. ha esaminato i cloni knockout utilizzando SE-ADM ad alta risoluzione, non hanno osservato MV, che è stata ulteriormente confermata mediante analisi spettrometrica per l'assenza di picchi di fosforo e calcio.
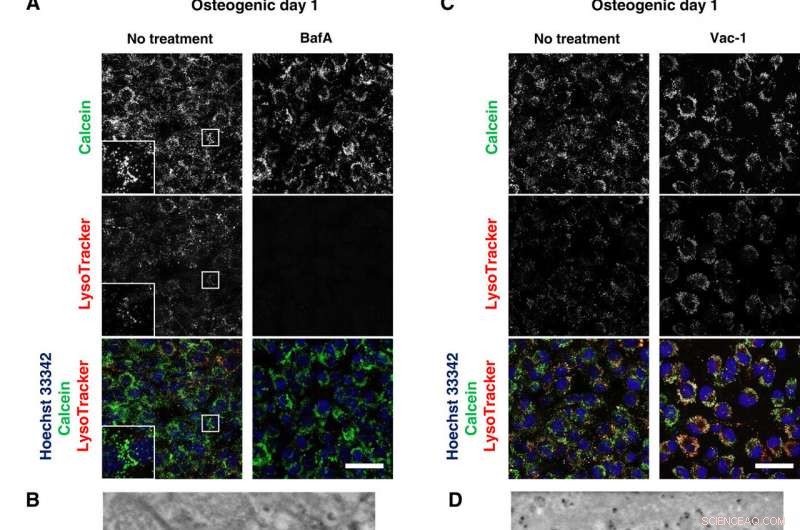
Gli inibitori lisosomiali bloccano la mineralizzazione. (A e C) Imaging confocale in tempo reale di osteoblasti trattati con BafA 50 nM o 10 μM Vac-1. Le cellule sono state coltivate in terreni osteogenici contenenti BafA o Vac-1 e colorate con Hoechst 33342 e LysoTracker Insets mostrano un ingrandimento maggiore e un'area riquadrata di ciascun canale. (B e D) Immagini SD-ADM di osteoblasti trattati con BafA o Vac-1. Le cellule sono state coltivate in terreni osteogenici contenenti BafA o Vac-1. (E) Colorazione Alizain Red S eseguita senza fissazione. Le cellule sono state coltivate in mezzi osteogenici contenenti BafA o Vac-1 e colorate con Alizain Red S. Immagini confocali rappresentative. Barre della scala, 50 micron in (A), (C), e (E); 2 micron (B) e (D). Credito:progressi scientifici, doi:10.1126/sciadv.aax0672
Dopo aver osservato direttamente la produzione e la secrezione di MV utilizzando SE-ADM, gli scienziati hanno ulteriormente studiato il coinvolgimento dei lisosomi nel traffico intracellulare di MV per osservare la mineralizzazione degli osteoblasti vivi. Hanno coltivato le cellule in terreni osteogenici contenenti calcio e le hanno colorate con LysoTracker per rilevare i componenti intracellulari di interesse. Iwayama et al. localizzato le vescicole piene di calceina abbinate ai lisosomi per suggerire la biogenesi delle MV all'interno dei lisosomi dopo la loro fusione con la calceina + vescicole. Gli scienziati hanno seguito gli esperimenti con studi sulla perdita di funzione e sull'inibizione funzionale per decostruire ulteriormente i percorsi ed esaminare i meccanismi d'azione intracellulari durante la mineralizzazione delle cellule vive in vitro.
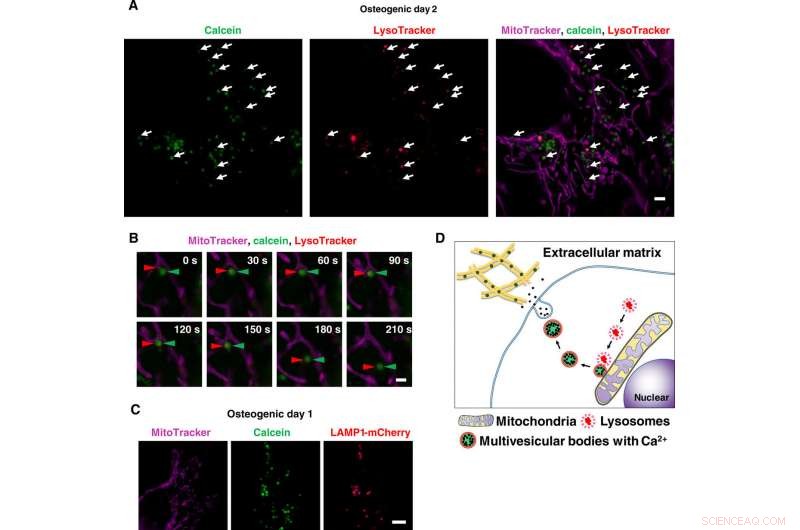
Imaging live a super risoluzione dei trasporti di vescicole contenenti calcio tramite lisosomi. (A) Istantanea di immagini SRM time-lapse di osteoblasti marcati con calceina. Le cellule sono state coltivate con calceina e colorate con Lysotracker e MitoTracker. Le frecce bianche indicano la colocalizzazione dei lisosomi e delle vescicole calceina-positive. (B) Primo piano di immagini SRM time-lapse di osteoblasti marcati con calceina. Le punte di freccia rosse indicano il lisosoma, e le frecce verdi indicano calceina. Una volta che i lisosomi si sono fusi con vescicole calceina-positive adiacenti ai mitocondri, they started to move toward extracellular space. (C) Representative SRM image of LAMP1-mCherry–expressing cells. Cells were transfected with LAMP1-mCherry plasmid, cultured with calcein, and stained with MitoTracker. Calcein-positive vesicles matched to LAMP1-mCherry–positive lysosomes. (D) Schematic view of lysosomal involvement in transportation of calcium in mineralizing osteoblasts. Barre della scala, 2 μm in (A), 1 μm in (B), and 10 μm in (C). Credito:progressi scientifici, doi:10.1126/sciadv.aax0672
Scientists had previously reported the involvement of mitochondria during mineralization due to the presence of electron-dense calcium and phosphorous-rich granules in osteoblast mitochondria. This was observed with a modified cryotechnique. Per di più, reports also suggest the direct contact of lysosomes and mitochondria with functional significance. When Iwayama et al. stained cells with LysoTracker together with MitoTracker and observed the intracellular components under N-SIM structured illumination super-resolution microscopy (SRM). They observed the presence of most calcein-fulfilled vesicles next to mitochondria and matched with lysosomes. During SRM-time lapse imaging, the scientists further obtained views of intracellular transport of LysoTracker containing vesicles fused to static calcein vacuoles adjacent to mitochondria to validate their hypothesis.
In questo modo, together with observations of other SRM systems and additional cell lines, Tomoaki Iwayama and colleagues proposed a mineralization mechanism. Wherein lysosomes played a central role in intracellular MV biogenesis and trafficking within osteoblasts. It was reasonable to involve lysosomes for osteoblasts to transport amorphous calcium phosphate without crystallization during its transport in the cytosol. The scientists aim to conduct further experiments to understand the regulatory molecules for MVs and investigate if MVs and exosomes have similar constitutions and mechanism underlying their generation, secretion and function. The SE-ADM strategy used in the present work can be installed into existing scanning electron microscopy apparatus at a low cost. The work developed in the study will offer non-invasive, high-resolution imaging at the nanoscale applicable to all scientific fields.
© 2019 Scienza X Rete