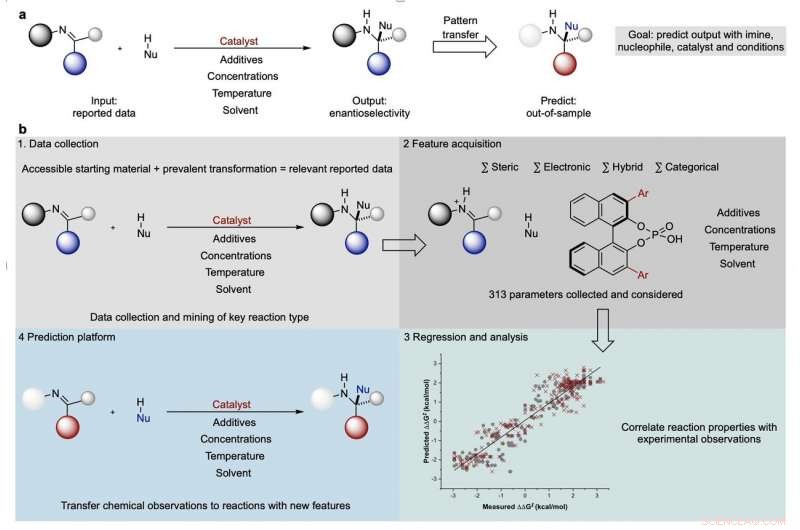
Il processo per lo sviluppo di modelli predittivi di reazioni chimiche. Credito:Jolene Reid e Matthew Sigman.
La chimica è molto più che mescolare il composto A con il composto B per creare il composto C. Ci sono catalizzatori che influenzano la velocità di reazione, nonché le condizioni fisiche della reazione e gli eventuali passaggi intermedi che portano al prodotto finale. Se stai cercando di creare un nuovo processo chimico per, dire, ricerca farmaceutica o sui materiali, devi trovare il meglio di ciascuna di queste variabili. È un processo per tentativi ed errori che richiede tempo.
O, almeno, era.
In una nuova pubblicazione in Natura , I chimici dell'Università dello Utah Jolene Reid e Matthew Sigman mostrano come l'analisi dei dati di reazione chimica pubblicati in precedenza possa prevedere come potrebbero procedere le reazioni ipotetiche, restringendo la gamma di condizioni che i chimici devono esplorare. Il loro processo di previsione algoritmica, che include aspetti del machine learning, può far risparmiare tempo e risorse preziose nella ricerca chimica.
"Cerchiamo di trovare la migliore combinazione di parametri, " Dice Reid. "Una volta che abbiamo ciò, possiamo regolare le caratteristiche di qualsiasi reazione e prevedere effettivamente come tale regolazione la influenzerà".
Prove ed errori
In precedenza, chimici che volevano realizzare una reazione mai provata prima, come una reazione per attaccare una particolare piccola molecola a un punto particolare su una molecola più grande, affrontato il problema cercando una reazione simile e imitando le stesse condizioni.
"Quasi ogni volta, almeno nella mia esperienza, non funziona bene, " dice Sigman. "Allora cambi sistematicamente le condizioni."
Ma con diverse variabili in ogni reazione - Sigman stima da sette a dieci in una tipica reazione farmaceutica - il numero di possibili combinazioni di condizioni diventa schiacciante. "Non puoi coprire tutto questo spazio variabile con nessun tipo di operazione ad alto rendimento, "Dice Sigman. "Stiamo parlando di miliardi di possibilità."
Restringere il campo
Così, Sigman e Reid hanno cercato un modo per restringere l'attenzione a una gamma di condizioni più gestibile. Per la loro reazione di prova, hanno esaminato le reazioni che coinvolgono molecole con immagini speculari opposte l'una dell'altra (nello stesso modo in cui le mani destra e sinistra sono immagini speculari l'una dell'altra) e che selezionano più per una configurazione che per un'altra. Tale reazione è chiamata "enantioselettiva, " e il laboratorio di Sigman studia i tipi di catalizzatori coinvolti nelle reazioni enantioselettive.
Reid ha raccolto rapporti scientifici pubblicati su 367 forme di reazioni che coinvolgono immine, che hanno una base azotata, e ha utilizzato algoritmi di apprendimento automatico per correlare le caratteristiche delle reazioni con quanto fossero selettive per le due diverse forme di immine. Gli algoritmi hanno esaminato i catalizzatori delle reazioni, solventi e reagenti, e relazioni matematiche costruite tra quelle proprietà e il finale selettivamente della reazione.
"C'è uno schema nascosto sotto la superficie del perché funziona e non funziona con questa condizione, questo catalizzatore, questo substrato, e così via, "dice Sigman.
"La chiave del nostro successo è che utilizziamo le informazioni provenienti da molte reazioni, " aggiunge Reid.
Alleviare il dolore
Quanto bene funziona il loro modello predittivo? Ha predetto con successo i risultati di 15 reazioni che coinvolgono un reagente che non era nel set originale, e i risultati di 13 reazioni in cui sia un tipo di reagente che di catalizzatore non erano nel set originale. Finalmente, Reid e Sigman hanno esaminato un recente studio che ha condotto 2, 150 esperimenti per trovare le condizioni ottimali di 34 reazioni. Senza sporcare un solo bicchiere, Il modello di Reid e Sigman è arrivato agli stessi risultati e allo stesso catalizzatore ottimale.
Reid non vede l'ora di applicare il modello alla previsione di reazioni che coinvolgono grandi, molecole complesse. "Spesso scopri che le nuove metodologie non sono messe a punto per sistemi complessi, "dice. "Forse potremmo farlo ora prevedendo in anticipo il miglior tipo di catalizzatore."
Sigman aggiunge che i modelli predittivi possono abbassare le barriere allo sviluppo di nuovi farmaci.
"L'industria farmaceutica non vuole investire denaro in qualcosa che non sa se funzionerà, "dice. "Allora, se hai un algoritmo che suggerisce che ha un'alta probabilità di funzionare, allevi il dolore."
Dopo la pubblicazione, qui trovi lo studio completo.