
Credito:Elena Khavina/MIPT
I ricercatori dell'Istituto di fisica e tecnologia di Mosca hanno pubblicato una recensione sulla cristallografia seriale a femtosecondi, uno dei metodi più promettenti per analizzare la struttura terziaria delle proteine. Questa tecnica si è rapidamente evoluta negli ultimi dieci anni, aprendo nuove prospettive per la progettazione razionale di farmaci mirati a proteine precedentemente inaccessibili all'analisi strutturale. L'articolo è uscito sul giornale Opinione di esperti sulla scoperta di farmaci .
Cristallografia a raggi X
La cristallografia a raggi X è uno dei principali metodi per rivelare la struttura 3-D delle macromolecole biologiche, come le proteine. Ha contribuito a determinare la struttura di numerosi enzimi e recettori farmacologicamente importanti, consentendo la progettazione di farmaci mirati a queste proteine.
Il metodo prevede la cristallizzazione di una proteina e lo studio tramite diffrazione dei raggi X. Innanzitutto la proteina viene isolata e purificata. Quindi il solvente si asciuga gradualmente. Di conseguenza, le molecole di cui si sta studiando la struttura formano cristalli, caratterizzato da un ordine interno. Esponendo un cristallo ai raggi X in un dispositivo speciale, i ricercatori ottengono un modello di diffrazione. Contiene informazioni sulle posizioni degli atomi nel cristallo. Un'attenta analisi del modello rivela la struttura 3-D delle molecole proteiche costituenti.
Prima dell'avvento di questo metodo, nuovi farmaci sono stati per lo più ricercati empiricamente:o modificando la struttura delle molecole note per influenzare la proteina bersaglio, o ordinando attraverso array di molecole in librerie chimiche. Ora che sono disponibili le strutture 3D di molte proteine bersaglio, i ricercatori possono visualizzarli sullo schermo di un computer e ordinare rapidamente milioni di composti alla ricerca di farmaci candidati. In questo modo risparmiano molto tempo e denaro precedentemente spesi per la sintesi chimica e gli esperimenti "umidi".
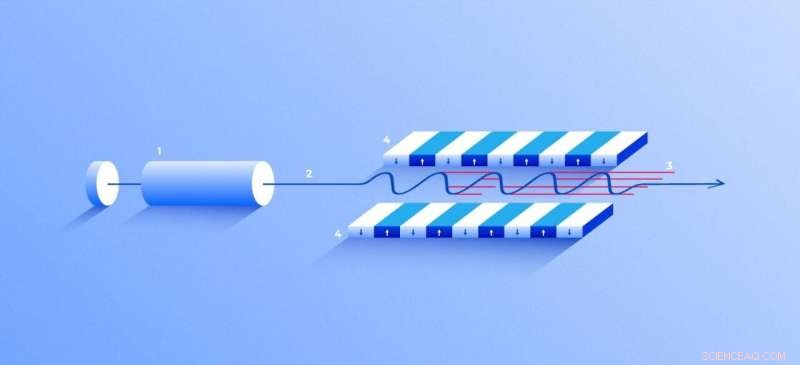
Laser a raggi X a elettroni liberi. Una sorgente (1) emette elettroni liberi (2) muovendosi solo decine di volte più lentamente della velocità della luce attraverso l'ondulatore (4), un tunnel rivestito con molti magneti. Il campo magnetico fa oscillare un elettrone che viaggia attraverso il tunnel e quindi emette raggi X. Il movimento degli elettroni nell'ondulatore è sincronizzato per generare stretti, impulsi di raggi X ad alta frequenza di notevole intensità (3). Credito:Elena Khavina/MIPT
La cristallografia a raggi X produce buoni risultati per cristalli di grandi dimensioni, stabile, e omogeneo, cioè senza impurità o difetti strutturali. Per rilevare meglio un segnale di diffrazione debole, è necessario un potente impulso di radiazione, ma non così potente da distruggere il cristallo. Nella cristallografia a raggi X convenzionale, un cristallo proteico viene ruotato nel raggio di raggi X per produrre modelli di diffrazione per vari orientamenti spaziali. Questo cattura la massima informazione sulla struttura.
Metodo per obiettivi difficili
Subito dopo la comparsa della cristallografia a raggi X, è diventato chiaro che non tutte le macromolecole biologiche possono essere cristallizzate. Alcune proteine sono normalmente disciolte nel mezzo cellulare interno. Quindi è abbastanza facile metterli in soluzione, evaporalo, e ottenere un grande cristallo regolare. Ma le proteine di membrana, molti recettori tra loro, formano cristalli che non sono abbastanza grandi e puri per la cristallografia a raggi X standard. Detto ciò, molte di queste proteine sono coinvolte nello sviluppo della malattia, il che significa che la loro struttura è di grande interesse per i farmacologi.
Meno di un decennio fa, è stata trovata una soluzione per le proteine di membrana. Questa nuova tecnica, chiamata cristallografia seriale a raggi X a femtosecondi, o effetti sonori, si basa su laser a raggi X a elettroni liberi, sviluppato poco prima di SFX.
Alexey Mishin, vice capo del Laboratorio di Biologia Strutturale dei Recettori del MIPT, chi è coautore dello studio, ha spiegato:"Ciò che la rende una tecnologia rivoluzionaria è un'altissima densità di energia dell'impulso laser. L'oggetto è esposto a radiazioni così potenti che cade a pezzi, inevitabilmente e quasi istantaneamente. Ma prima che lo faccia, alcuni singoli quanti dell'impulso laser si disperdono dal campione e finiscono al rivelatore. Questo è il cosiddetto principio di diffrazione prima della distruzione per studiare la struttura della proteina originale".

Due modi per alimentare i cristalli nell'area operativa del dispositivo:in un flusso di liquido (3, sinistra) e su un supporto solido (3, Giusto). In entrambi i casi, il fascio di raggi X (2) che attraversa i cristalli genera un pattern di diffrazione sullo schermo (1). Credito:Elena Khavina/MIPT
I laser a elettroni liberi a raggi X si sono rivelati utili al di fuori della biologia:negli ultimi anni, SFX è stato utilizzato sempre più spesso da fisici e chimici, pure. Il primo dispositivo è diventato disponibile per gli sperimentatori nel 2009, e ora ci sono cinque centri aperti ai ricercatori negli Stati Uniti, Giappone, Corea del Sud, Germania, e Svizzera. Uno nuovo è in costruzione in Cina, e la struttura statunitense, storicamente la prima, ha annunciato piani per la modernizzazione.
Mentre la nuova tecnologia ha offerto ai ricercatori uno sguardo sulla struttura delle proteine che in precedenza eludeva l'analisi, ha anche promosso nuove soluzioni tecniche e matematiche. La cristallografia a raggi X convenzionale comporta l'esposizione di un cristallo alla radiazione da varie angolazioni e l'analisi collettiva dei modelli di diffrazione risultanti. Nell'effetto sonoro, il cristallo viene istantaneamente distrutto dalla prima interazione con un potente impulso a raggi X. Quindi i ricercatori devono ripetere il processo con molti piccoli cristalli e analizzare i dati "seriali" così generati, da qui il nome del metodo.
Un'ulteriore sfida è selezionare i campioni per SFX. Nella cristallografia a raggi X convenzionale, semplicemente scegliere il cristallo più grande e della più alta qualità era la strada da percorrere. Questo potrebbe essere fatto manualmente, guardando i campioni disponibili. La nuova procedura richiede di lavorare con una sospensione di tanti piccoli cristalli di varie dimensioni e qualità. Centrifughe e filtri con dimensioni dei pori note vengono utilizzate per separare i cristalli per dimensione.
È stato necessario elaborare metodi per posizionare i campioni nella camera, pure. I laser a raggi X a elettroni liberi hanno una certa frequenza massima alla quale possono emettere impulsi di radiazione. Per ridurre le spese e il consumo di tempo, nuovi cristalli dovrebbero essere introdotti nella camera alla stessa frequenza. Finora, sono stati sviluppati due approcci per farlo. Sotto il primo, i cristalli entrano nella camera in sospensione liquida, fornito da un iniettore. Il getto in uscita dall'iniettore viene "schiacciato" da un flusso di gas per garantire il corretto posizionamento del campione. Questo è, durante il passaggio, un cristallo finisce esattamente al centro del raggio laser (fig. 2, sinistra). In alternativa, i cristalli proteici possono essere sparsi su un substrato trasparente ai raggi X e alimentati automaticamente nel raggio laser prima di ogni impulso (fig. 2, Giusto).
Da quando ha prodotto i suoi primi risultati nel 2011, SFX ha rivelato oltre 200 strutture proteiche. Tra questi ci sono 51 bersagli potenzialmente importanti per la farmacologia:recettori di membrana, fermenti, proteine virali, ecc, che prima erano inaccessibili alle tecniche analitiche convenzionali.
La revisione sistematica della tecnologia applicata alla biologia e alla farmacologia da parte del team MIPT aiuterà senza dubbio altri ricercatori che cercano di ottenere le strutture dei principali bersagli farmacologici per sviluppare nuovi farmaci.