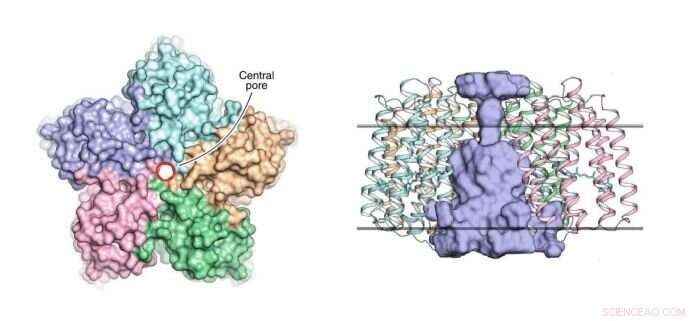
A sinistra:una vista del pentamero OLPVRII dal lato citoplasmatico. Il poro centrale è contornato da un cerchio rosso. A destra:una vista laterale del pentamero. Il poro centrale è di colore azzurro. I confini del nucleo della membrana idrofoba/idrofila sono mostrati come linee orizzontali continue. Credito:Dmitry Bratanov et al./Nature Communications
La struttura di una rodopsina II organica del Phycodnavirus del lago (OLPVRII), che è una proteina unica che si trova nel genoma dei virus giganti, è stato determinato grazie al lavoro di laureati e dottorandi del MIPT. studenti. Il documento è stato pubblicato in Comunicazioni sulla natura .
Lo studio è il risultato di una collaborazione che ha coinvolto molti ex-alunni del MIPT. Dmitry Bratanov era tra loro. Dmitrij, che attualmente lavora presso l'Institute of Complex Systems (ICS-6) presso il Centro di ricerca Juelich, Germania, afferma che sebbene le rodopsine virali siano state scoperte per la prima volta nei cosiddetti virus giganti diversi anni fa, la loro struttura, funzione, e il ruolo biologico sono rimasti finora poco chiari.
Un virus gigante è un virus molto grande, le dimensioni di un tipico batterio. È così grande che è visibile al microscopio ottico. I virus giganti infettano le alghe verdi, che producono ossigeno e aiutano a mantenere l'equilibrio ecologico naturale dell'oceano mondiale. Perciò, i virus giganti sono di notevole interesse per la ricerca dal punto di vista ambientale.
"In questo lavoro, abbiamo decifrato la struttura ad alta risoluzione di OLPVRII, caratterizzato funzionalmente la proteina, e ha dimostrato che forma pentameri non solo nei cristalli ma anche nelle membrane lipidiche, " spiega Dmitry. "Non è stato un compito facile. Sono stati necessari numerosi esperimenti, per alcuni di essi abbiamo utilizzato tecniche e attrezzature sofisticate. Quello che abbiamo ottenuto è il risultato del duro e meticoloso lavoro del gruppo internazionale di scienziati".
Questa organizzazione pentamerica è stata precedentemente osservata in alcune altre rodopsine, come, ad esempio, nella pompa del sodio azionata dalla luce KR2. Però, ciò che rende peculiare la struttura di OLPVRII è che presenta un insolito poro al centro (vedi figura 1). La sua funzione rimane sconosciuta.
"Pensiamo che forse il poro funge da canale ionico, molto probabilmente per gli ioni cloruro, "dice Kirill Kovalev, un co-autore del documento e dottorato di ricerca. studente al MIPT.
I canali ionici sono proteine che creano un percorso passivo per il flusso degli ioni attraverso la membrana cellulare. Questi canali sono solitamente chiusi al buio, il che significa che gli ioni non possono entrare o uscire dalla cellula. Nel caso di canali fotosensibili, si aprono in risposta all'assorbimento della luce, che consente agli ioni di scorrere lungo il gradiente di concentrazione. In altre parole, gli ioni si muovono nella direzione che livellerebbe le concentrazioni di ioni all'interno e all'esterno della cellula.
Un tipico esempio di canale sensibile alla luce è channelrhodopsin 2. È stato trovato nell'alga verde Chlamydomonas reinhardtii ed è ampiamente utilizzato come strumento optogenetico. Per quanto riguarda OLPVRII, i ricercatori pensano che questo potrebbe essere il primo canale ionico pentamerica controllato dalla luce mai scoperto, come suggerito dalla struttura determinata e dalle simulazioni molecolari.
"Però, l'attività del canale di OLPVRII deve ancora essere dimostrata, " nota Kirill Kovalev." Continueremo la nostra ricerca e scopriremo sicuramente perché questa insolita rodopsina è stata creata dalla natura. Forse aiuta l'ospite a continuare a svolgere le sue funzioni vitali quando una cellula è infettata da un virus, o forse è un sensore."
Detto ciò, lo studio della struttura della rodopsina virale ha fatto luce su come funziona. È stato dimostrato che OLPVRII, come la maggior parte delle altre rodopsine, agisce come una pompa protonica. Tuttavia è improbabile che questa sia la sua funzione principale, dicono i ricercatori. Il suo scopo principale deve ancora essere studiato e dimostrato.
"Se dimostriamo che questa rodopsina virale è in realtà un canale ionico, può diventare un ottimo strumento in optogenetica e applicazioni biomediche, " dice il coautore Valentin Gordeliy, che guida gruppi di ricerca presso l'Istituto di Biologia Strutturale di Grenoble e il Centro di Ricerca Juelich. Valentin è anche coordinatore della ricerca presso il Centro di ricerca del MIPT sui meccanismi molecolari dell'invecchiamento e delle malattie legate all'età.
I ricercatori affermano che il nuovo strumento supererà tutte le sue controparti grazie ai vantaggi della sua struttura pentamerica:la facilità con cui è possibile manipolare geneticamente le proprietà della proteina e forse le alte correnti che circolano attraverso il poro centrale.
Per avere il diritto prioritario di utilizzare la loro invenzione, gli autori dell'articolo hanno presentato una domanda di brevetto per l'uso della rodopsina virale OLPVRII nel campo dell'optogenetica.
L'optogenetica è una branca della biofisica che utilizza la luce per controllare le cellule di un organismo vivente. Come è già stato dimostrato, l'optogenetica può essere applicata per ripristinare la vista e la perdita dell'udito, aiutare a controllare il movimento nei pazienti neurologici, e curare quelli con il morbo di Parkinson e di Alzheimer.
Secondo Valentin Gordeliy, Il MIPT dispone di tutte le attrezzature necessarie per condurre uno studio dettagliato delle funzioni della rodopsina virale. Il gruppo continuerà la sua ricerca su OLPVRII, che sarà di grande importanza per la biologia, scienza dell'evoluzione, optogenetica, ed ecologia.