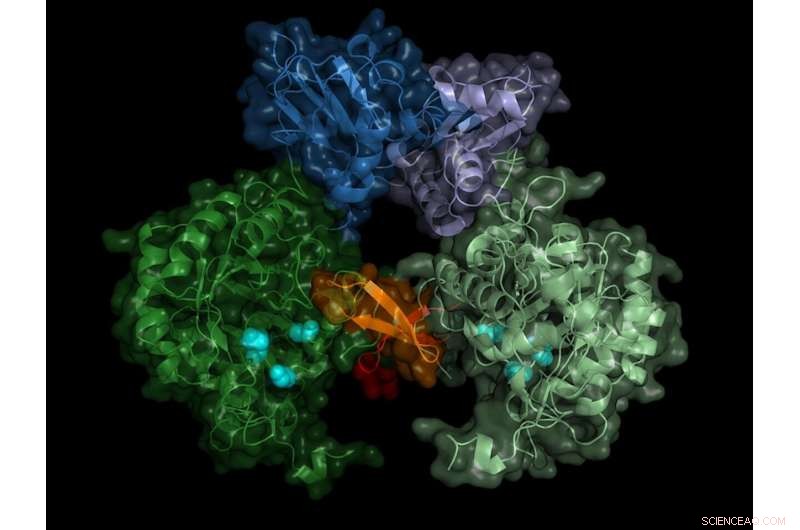
Struttura dell'IMP deidrogenasi del parassita. L'enzima attivo forma coppie (dimeri), la regione "interruttore" (regione di Bateman) è mostrata nei toni del blu. Credito:Università di Lubecca/DESY, Lars Redecke
Utilizzando flash a raggi X ultra luminosi, un team di ricercatori ha individuato un potenziale bersaglio per nuovi farmaci contro la malattia del sonno:gli scienziati hanno decodificato la struttura spaziale dettagliata di un enzima vitale del patogeno, il parassita Trypanosoma brucei. Il risultato fornisce un possibile progetto per un farmaco che blocca specificamente questo enzima e quindi uccide il parassita, come il team guidato da Christian Betzel dell'Università di Amburgo, Lars Redecke dell'Università di Lubecca e DESY, e Henry Chapman di DESY riporta sulla rivista Comunicazioni sulla natura .
La malattia del sonno (tripanosomiasi africana) è una malattia tropicale causata dal parassita Trypanosoma brucei, che viene trasmesso dal morso delle mosche tse-tse, che abitano gran parte dell'Africa tropicale. Nel corpo, il parassita si moltiplica prima sotto la pelle, nel sangue e nel sistema linfatico per poi migrare nel sistema nervoso centrale. Se non trattata, la malattia è quasi sempre fatale. Grazie a misure di controllo intensivo, il numero di casi registrati è diminuito drasticamente negli ultimi anni. Tuttavia, la malattia del sonno è ancora considerata una delle malattie tropicali più significative. Secondo l'Organizzazione Mondiale della Sanità, più di 60 milioni di persone nelle aree rurali dell'Africa subsahariana sono a rischio. Guerra, lo spostamento e la migrazione possono far divampare la malattia.
Nella ricerca di un possibile punto di partenza per farmaci contro il patogeno, i ricercatori avevano preso di mira un enzima centrale dell'organismo unicellulare, inosina-5'-monofosfato deidrogenasi (IMPDH). "Questo enzima appartiene all'inventario centrale di ogni organismo ed è un bersaglio interessante per i farmaci perché regola la concentrazione di due nucleotidi vitali nella cellula:guanosina difosfato e guanosina trifosfato, " dice Redecke. "La cellula ha bisogno di questi nucleotidi per fornire energia e per costruire strutture più grandi come il genoma. Se interrompi questo ciclo, la cellula muore".
L'enzima ha una sorta di interruttore on/off che viene attivato dall'aggancio delle molecole della cellula. Un approccio promettente è bloccare questo interruttore con una molecola su misura. Per costruire un tale inibitore, l'esatta struttura spaziale dell'interruttore deve essere nota. I biologi strutturali possono determinare la struttura delle biomolecole usando i raggi X. Per fare questo, prima fanno crescere piccoli cristalli dalle biomolecole, che poi generano schemi di diffrazione caratteristici quando illuminati con raggi X. Da questi modelli la struttura atomica del cristallo e dei suoi mattoni, le biomolecole, può essere calcolato.
Questo approccio è spesso complicato dall'intrattabilità della maggior parte delle biomolecole contro la formazione di cristalli. E se tali cristalli possono essere coltivati, di solito sono estremamente sensibili ai raggi X ad alta energia e vengono rapidamente distrutti. "Sebbene siano già note le strutture di numerose IMP deidrogenasi, non c'era stato alcun successo nella crescita dei cristalli della versione Trypanosoma brucei dell'enzima, " riferisce Betzel, che è anche ricercatore nel Cluster of Excellence CUI:Advanced Imaging of Matter presso l'Università di Amburgo e DESY.

La malattia è trasmessa dalla mosca tse-tse. Credito:CDC, Kay DeWitt (dominio pubblico)
Il team ha quindi scelto un percorso alternativo:il gruppo del coautore Michael Duszenko dell'Università di Tubinga ha indotto alcune cellule di insetti a cristallizzare biomolecole al loro interno. Usando questa cosiddetta cristallizzazione in cellulo, lo stesso team aveva già decifrato un altro enzima chiave del patogeno della malattia del sonno, catepsina B, che è anche un potenziale bersaglio farmacologico. Si è scoperto che le cellule dell'insetto alterate producono anche cristalli della deidrogenasi ora studiata. Questi cristalli formano minuscoli aghi di circa 5 millesimi di millimetro (5 micrometri) di spessore e lunghi fino a 70 micrometri, in modo che sporgessero dalle cellule produttrici.
I cristalli in-cellulo sono così piccoli che sono necessari raggi X molto luminosi per analizzarli. Più grande è un cristallo, più atomi al suo interno possono disperdere i raggi X, causando un modello di diffrazione migliore. I ricercatori hanno quindi utilizzato il laser a raggi X LCLS presso lo SLAC National Accelerator Laboratory negli Stati Uniti per l'analisi. "I laser a raggi X generano lampi estremamente intensi, " spiega Chapman, che è Lead Scientist presso DESY nel Center for Free-Electron Laser Science CFEL e uno dei portavoce del Cluster of Excellence CUI:Advanced Imaging of Matter. "Anche se i cristalli sensibili evaporano immediatamente, prima generano un modello di diffrazione da cui è possibile ottenere la struttura." Il metodo utilizzato qui per sfruttare queste proprietà, chiamata cristallografia seriale a femtosecondi, è stato sviluppato in precedenza da molti dei ricercatori coinvolti in questo studio e nominato una delle prime dieci scoperte dell'anno dalla rivista Science nel 2013.
Il team ha registrato i modelli di diffrazione di oltre 22, 000 microcristalli ed è stato in grado di calcolare la struttura spaziale dell'enzima con una precisione di 0,28 milionesimi di millimetro (nanometro), che corrisponde all'incirca al diametro di un atomo di alluminio. "Il risultato non mostra solo l'esatta struttura dell'interruttore enzimatico, la regione di Bateman, ma anche quali molecole della cellula attivano l'interruttore e come questi cosiddetti cofattori si legano all'interruttore enzimatico, " riferisce Karol Nass che ha svolto questo lavoro durante i suoi studi di dottorato presso DESY. Ora lavora presso l'Istituto Paul Scherrer in Svizzera ed è, insieme a Redecke, uno dei principali autori della pubblicazione.
L'interruttore è azionato dalle molecole adenosina trifosfato (ATP) e guanosina monofosfato (GMP). "Il vantaggio del nostro metodo non è solo che siamo in grado di studiare l'enzima a temperatura ambiente, in cui l'enzima opera naturalmente, ma anche che durante la cristallizzazione della cellulosa i cofattori naturali si legano all'enzima, " ha detto Betzel. Secondo il ricercatore, i dati potrebbero ora fornire un approccio per inibire l'IMP deidrogenasi del parassita. "Si potrebbe pensare di costruire una sorta di fermaglio che copra i siti di legame di entrambi i cofattori, Per esempio."
Però, una sfida rimanente è progettare l'inibitore dell'IMP deidrogenasi in modo così specifico da bloccare l'enzima del parassita, ma non l'enzima umano. Se questo ha successo, il metodo potrebbe essere potenzialmente esteso ad altri patogeni, spiega Betzel. "Altri parassiti hanno una struttura molto simile, e potrebbe anche essere possibile attaccarli tramite la rispettiva IMP deidrogenasi. L'enzima è un bersaglio molto interessante per i farmaci, per esempio contro la tenia della volpe o il patogeno dell'elefantiasi".
Le università di Amburgo, Lubecca e Tubinga, l'Accademia Russa delle Scienze, Università statale dell'Arizona, il Lawrence Livermore National Laboratory negli Stati Uniti, l'Istituto Max Planck per la ricerca medica, il National Accelerator Laboratory SLAC degli Stati Uniti, l'Università di Göteborg e DESY sono state coinvolte in questa ricerca.