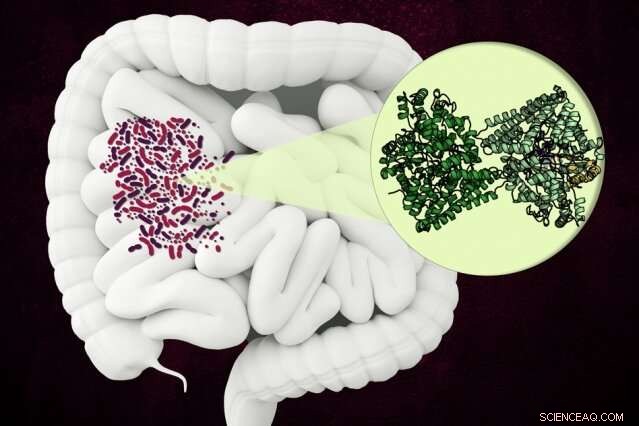
I ricercatori del MIT hanno scoperto la struttura di un insolito enzima che alcuni microbi usano per scomporre un componente del collagene nell'intestino umano. Credito:Christine Daniloff, MIT
I chimici del MIT e dell'Università di Harvard hanno scoperto la struttura di un insolito enzima batterico in grado di scomporre un amminoacido presente nel collagene, che è la proteina più abbondante nel corpo umano.
L'enzima, noto come idrossi-L-prolina deidratasi (HypD), è stato trovato in alcune centinaia di specie di batteri che vivono nell'intestino umano, Compreso Clostridioides difficile . L'enzima esegue una nuova reazione chimica che smantella l'idrossi-L-prolina, la molecola che conferisce al collagene la sua resistenza, struttura a tripla elica.
Ora che i ricercatori conoscono la struttura dell'enzima, possono provare a sviluppare farmaci che lo inibiscono. Un farmaco del genere potrebbe essere utile nel trattamento C. difficile infezioni, resistenti a molti antibiotici esistenti.
"Questo è molto eccitante perché questo enzima non esiste negli esseri umani, quindi potrebbe essere un potenziale bersaglio, "dice Catherine Drennan, un professore di chimica e biologia del MIT e un investigatore dell'Howard Hughes Medical Institute. "Se potessi potenzialmente inibire quell'enzima, quello potrebbe essere un antibiotico unico."
Drennan ed Emily Balskus, professore di chimica e biologia chimica all'Università di Harvard, sono gli autori senior dello studio, che appare oggi sul giornale eLife . La studentessa laureata al MIT Lindsey Backman e l'ex studentessa laureata ad Harvard Yolanda Huang sono gli autori principali dello studio.
Una reazione difficile
L'enzima HypD fa parte di una vasta famiglia di proteine chiamate enzimi radicali glicilici. Questi enzimi funzionano in modo insolito, convertendo una molecola di glicina, l'amminoacido più semplice, in un radicale, una molecola che ha un elettrone spaiato. Poiché i radicali sono molto instabili e reattivi, possono essere usati come cofattori, che sono molecole che aiutano a guidare una reazione chimica che altrimenti sarebbe difficile da eseguire.
Questi enzimi funzionano meglio in ambienti che non hanno molto ossigeno, come l'intestino umano. Il Progetto Microbioma Umano, che ha sequenziato migliaia di geni batterici da specie presenti nell'intestino umano, ha prodotto diversi tipi di enzimi radicali glicilici, compreso HypD.
In uno studio precedente, Balskus e i ricercatori del Broad Institute del MIT e di Harvard hanno scoperto che HypD può scomporre l'idrossi-L-prolina in un precursore della prolina, uno degli amminoacidi essenziali, rimuovendo la modifica idrossi come una molecola di acqua. Questi batteri possono infine utilizzare la prolina per generare ATP, una molecola che le cellule usano per immagazzinare energia, attraverso un processo chiamato fermentazione degli amminoacidi.
HypD è stato trovato in circa 360 specie di batteri che vivono nell'intestino umano, e in questo studio, Drennan e i suoi colleghi hanno utilizzato la cristallografia a raggi X per analizzare la struttura della versione di HypD trovata in C. difficile . Nel 2011, questa specie di batteri è stata responsabile di circa mezzo milione di infezioni e 29, 000 morti negli Stati Uniti.
I ricercatori sono stati in grado di determinare quale regione della proteina forma il "sito attivo" dell'enzima. " che è dove avviene la reazione. Una volta che l'idrossi-L-prolina si lega al sito attivo, una vicina molecola di glicina forma un radicale glicilico che può passare quel radicale sull'idrossi-L-prolina, portando all'eliminazione del gruppo ossidrile.
La rimozione di un gruppo idrossi è solitamente una reazione difficile che richiede un grande apporto di energia.
"Trasferendo un radicale all'idrossi-L-prolina, abbassa la barriera energetica e permette che quella reazione avvenga abbastanza rapidamente, "Dice Backman. "Non c'è nessun altro enzima conosciuto in grado di eseguire questo tipo di chimica."
Nuovo bersaglio farmacologico
Sembra che una volta che i batteri eseguono questa reazione, deviano la prolina nelle proprie vie metaboliche per aiutarli a crescere. Perciò, il blocco di questo enzima potrebbe rallentare la crescita dei batteri. Questo potrebbe essere un vantaggio nel controllo C. difficile , che spesso esiste in piccole quantità nell'intestino umano, ma può causare malattie se la popolazione diventa troppo grande. Questo a volte si verifica dopo un trattamento antibiotico che spazza via altre specie e consente C. difficile proliferare.
" C. difficile può essere nel tuo intestino senza causare problemi:è quando ne hai troppo rispetto ad altri batteri che diventa più problematico, "Drennan dice. "Allora, l'idea è che prendendo di mira questo enzima, potresti limitare le risorse di C. difficile , senza necessariamente ucciderlo."
I ricercatori ora sperano di iniziare a progettare farmaci candidati che potrebbero inibire l'HypD, mirando agli elementi della struttura proteica che sembrano essere i più importanti nello svolgimento della sua funzione.