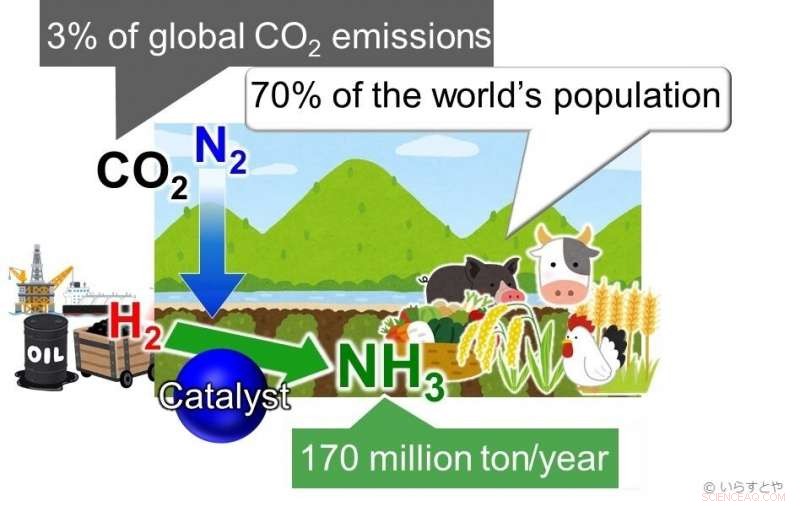
L'ammoniaca (NH3) è oggi uno dei più importanti prodotti chimici industriali, sintetizzati a livello globale per l'uso in fertilizzanti che poi consentono la produzione di cibo per circa il 70% della popolazione mondiale. L'ammoniaca è attualmente ottenuta facendo reagire l'azoto (N2) dall'aria con l'idrogeno (H2). Questa reazione richiede alta energia ed è, perciò, alimentato da combustibili fossili, contribuendo a oltre il 3% delle emissioni globali di CO2. Attestazione:Irasutoya, Michikazu Hara
Gli scienziati del Tokyo Institute of Technology (Tokyo Tech) hanno sviluppato un catalizzatore migliorato prendendo il comune agente disidratante idruro di calcio e aggiungendovi fluoro. Il catalizzatore facilita la sintesi dell'ammoniaca a soli 50 °C, utilizzando solo la metà dell'energia richiesta dalle tecniche esistenti. Questo apre le porte alla produzione di ammoniaca con un basso consumo energetico e una ridotta emissione di gas serra.
L'ammoniaca è fondamentale per produrre fertilizzanti per piante, che a sua volta alimenta circa il 70% della popolazione mondiale. Nell'industria, l'ammoniaca viene prodotta tramite il processo Haber-Bosch, dove il metano viene prima fatto reagire con il vapore per produrre idrogeno, e l'idrogeno viene quindi fatto reagire con azoto per dare ammoniaca. Il problema con questo processo è che all'aumentare della temperatura, la resa diminuisce. Per continuare ad ottenere una buona resa, la pressione applicata nella camera di reazione deve essere aumentata. Ciò richiede molta energia. Ulteriore, i catalizzatori a base di ferro utilizzati per la reazione sono efficaci solo al di sopra di 350 °C. Il mantenimento di temperature così elevate richiede anche una notevole quantità di energia. Per completare il tutto, la resa è solo del 30-40%.
I combustibili fossili sono attualmente utilizzati per alimentare il processo, apportando grandi quantità di anidride carbonica nell'atmosfera. alternative di risorse rinnovabili, come l'energia eolica, sono stati applicati, ma quelli non si sono dimostrati sostenibili. Per aumentare la resa riducendo i danni all'ambiente, perciò, la reazione deve avvenire a basse temperature. Perché ciò accada, sono richiesti catalizzatori che consentano la reazione a basse temperature.
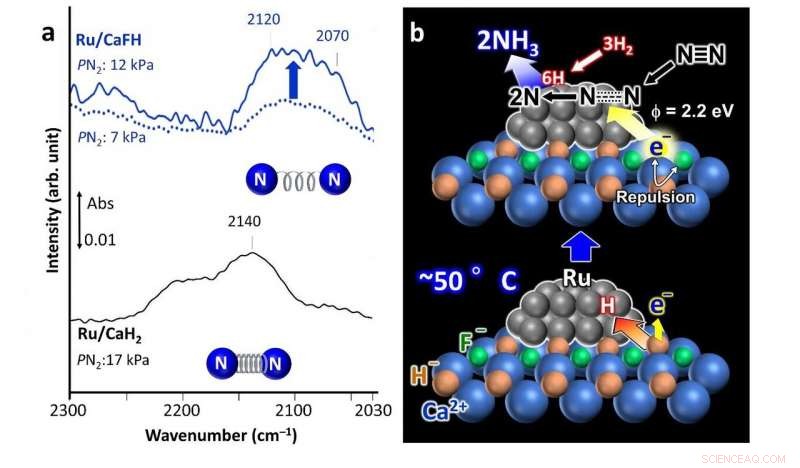
a) Spettri infrarossi a trasformata di Fourier (FT-IR) per l'assorbimento di azoto sul catalizzatore Ru/CaFH contenente fluoro sviluppato (in alto) che mostra un legame indebolito tra gli atomi di azoto rispetto a un catalizzatore Ru/CaH2 non modificato (spettro inferiore). b) Meccanismo di reazione proposto utilizzando il catalizzatore Ru/CaFH. Credito: Comunicazioni sulla natura
Finora, tali catalizzatori sono stati elusivi per gli scienziati. "I catalizzatori convenzionali perdono l'attività catalitica per la formazione di ammoniaca da N 2 e H 2 gas a 100-200 °C, anche se presentano elevate prestazioni catalitiche alle alte temperature, " fa notare un gruppo di scienziati della Tokyo Tech, Giappone, che sembrano aver finalmente risolto il problema del catalizzatore. Gli scienziati, guidato dal dottor Michikazu Hara, sviluppato un catalizzatore che è efficace anche a 50 °C. "Il nostro catalizzatore produce ammoniaca da N 2 e H 2 gas a 50 °C con un'energia di attivazione estremamente ridotta di 20 kJmol -1 , che è meno della metà di quella riportata per i catalizzatori convenzionali, " Il Dr. Hara e colleghi riferiscono nel loro articolo pubblicato su Comunicazioni sulla natura .
Il loro catalizzatore comprende una soluzione solida di CaFH, con nanoparticelle di rutenio (Ru) depositate sulla sua superficie. L'aggiunta di fluoro (F - ) in idruro di calcio (CaH 2 ), un comune agente disidratante, è ciò che rende il catalizzatore efficace a temperature e pressioni inferiori. Dopo aver condotto analisi spettroscopiche e computazionali, gli scienziati propongono un possibile meccanismo attraverso il quale il catalizzatore facilita la produzione di ammoniaca.
Il legame calcio-fluoruro (Ca-F) è più forte del legame calcio-idrogeno (Ca-H). Così, la presenza del legame Ca-F indebolisce il legame Ca-H e il Ru è in grado di estrarre atomi di H dal cristallo catalizzatore, lasciando gli elettroni al loro posto. Gli atomi di H poi si desorbono dalle nanoparticelle di Ru come H 2 gas. Ciò si verifica anche a 50 °C. La risultante repulsione di carica tra gli elettroni intrappolati e F - gli ioni nel cristallo abbassano le barriere energetiche per il rilascio di questi elettroni, conferendo così al materiale un'elevata capacità di donazione di elettroni. Questi elettroni rilasciati attaccano i legami tra gli atomi di azoto nel N 2 gas, facilitando la produzione di ammoniaca.
Questo nuovo metodo di produzione dell'ammoniaca riduce la domanda di energia, riducendo così le emissioni di anidride carbonica derivanti dall'uso di grandi quantità di combustibili fossili. I risultati di questo studio illuminano la possibilità di un processo Haber-Bosch ambientalmente sostenibile, aprendo le porte alla prossima rivoluzione nella produzione agroalimentare.