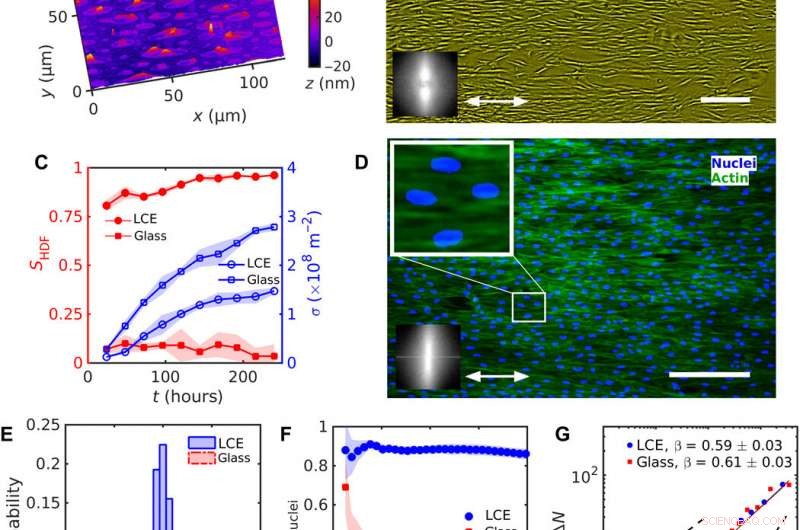
Allineamento uniforme delle celle HDF su LCE con nˆLCE=const uniforme. (A) Microscopia olografica digitale (DHM) tessitura della superficie LCE dopo il contatto con il mezzo di crescita acquoso. (B) Struttura al microscopio a contrasto di fase (PCM) delle cellule HDF che crescono su substrati LCE a 120 ore dopo la semina. La freccia a due punte rappresenta nˆLCE. (C) Evoluzione del parametro d'ordine SHDF dei corpi cellulari (simboli rossi pieni) e densità cellulare (simboli blu vuoti). (D) Texture microscopiche fluorescenti di cellule HDF su LCE; nuclei marcati con fluorescenza (blu) e proteine F-actina del citoscheletro (verde). La trama ingrandita mostra nuclei allungati orientati nella stessa direzione dei corpi delle cellule. I riquadri in (B) e (D) mostrano una rapida trasformazione di Fourier di (B) PCM e (D) trame fluorescenti di F-actina che indicano l'ordine orientativo lungo l'uniforme nˆLCE. (E) Distribuzione dell'orientamento dei nuclei. (F) Dipendenza del parametro d'ordine Snuclei dei nuclei dalla dimensione di una sottofinestra quadrata. (G) Fluttuazioni numeriche di densità ΔN calcolate per il numero medio di nuclei cellulari 〈N〉. Barre della scala, 300 micron. Credito:progressi scientifici, doi:10.1126/sciadv.aaz6485
Le cellule eucariotiche all'interno dei tessuti viventi possono influenzare importanti processi fisiologici come l'apoptosi e la migrazione cellulare in base alla formazione di modelli dinamici con orientamenti spazialmente variabili. Però, è ancora difficile proiettare una mappa prestabilita dell'ordine orientativo su un tessuto in crescita in laboratorio. In un nuovo studio ora pubblicato su Progressi scientifici , Taras Turiv e un gruppo di ricerca in fisica chimica, materiali avanzati e scienze biomediche presso la Kent State University, Ohio, NOI., dettagliato un nuovo approccio per produrre monostrati cellulari di fibroblasti dermici umani. Hanno preprogettato i modelli di orientamento e i difetti topologici utilizzando un elastomero a cristalli liquidi fotoallineato (LCE) che si gonfia anisotropicamente in un mezzo acquoso. Il team ha iscritto i modelli nella LCE, e il monostrato di tessuto ha replicato i modelli per causare forti variazioni ai fenotipi cellulari (dimensioni e forma), la loro densità superficiale e le fluttuazioni della densità numerica. Il nuovo approccio può controllare il comportamento collettivo delle cellule nei tessuti viventi durante la differenziazione cellulare e la morfogenesi dei tessuti per ampie applicazioni in bioingegneria e medicina rigenerativa.
Le cellule che costituiscono i tessuti viventi spesso mostrano un ordine orientativo quando sono in stretto contatto a causa dell'allineamento reciproco delle cellule anisometriche. La direzione dell'orientamento medio può variare nello spazio e nel tempo per produrre difetti topologici noti come disclinazioni. Tali difetti possono spostarsi all'interno del tessuto per svolgere un ruolo importante durante gli stress e i processi compressivi-dilatativi, compresa l'estrazione delle cellule morte. La capacità di progettare un'impalcatura tissutale di cellule viventi con ordine e controllo orientativi è importante per i ricercatori biomedici in modo da indagare e manipolare la materia vivente. Gli scienziati hanno già prodotto gruppi cellulari ordinati su superfici fabbricate litograficamente, compresi i bordi dei microcanali, in microscanalature e superfici con gradienti di rigidità del materiale. In questo lavoro, Turiv et al. tessuti progettati con un alto grado di ordine orientativo e direzione spazialmente variabile predeterminata, basato su un modello di modelli di regista su substrati LCE. Il team ha utilizzato cellule di fibroblasti dermici umani (HDF) come unità costitutive del tessuto modellato.
I grani di materiale fungono da binario di guida per le celle HDF. Credito:progressi scientifici, doi:10.1126/sciadv.aaz6485
I fibroblasti sono le cellule del tessuto connettivo dei mammiferi più comuni e di solito mantengono una forma allungata piatta con ruoli importanti durante la riparazione e la ristrutturazione dei tessuti, così come la guarigione delle ferite. Gli scienziati possono riprogrammare queste cellule in cellule staminali pluripotenti per applicazioni promettenti nella diagnostica e nella terapia. In questo lavoro, gli effetti combinati della semina cellulare e della divisione dei tessuti HDF modellati su substrati LCE predefiniti hanno prodotto tessuti confluenti. La LCE strutturata ha avuto un forte impatto sul tessuto, dove controllavano il modello di allineamento e la distribuzione spaziale delle cellule, la loro densità, fluttuazioni, e fenotipo. L'LCE modellato ha mostrato le posizioni dei difetti topologici nei tessuti attraverso interazioni di superficie anisotrope in posizioni predeterminate. Poiché l'allineamento cellulare e i difetti topologici possono controllare i processi biochimici su microscala, questo lavoro apre la possibilità di ingegnerizzare superfici per il patterning tissutale controllato al fine di progettarle per funzioni specifiche.
Durante gli esperimenti, Turiv et al. ha sostenuto il substrato LCE da una lastra di vetro e lo ha ricoperto con ossido di indio e stagno (ITO) per ridurre la rugosità superficiale, seguito dal rivestimento di uno strato di colorante azoico fotosensibile e infine coperto il substrato con un mezzo acquoso di coltura cellulare. I grani superficiali sul materiale servivano da guida per le celle HDF. Quando le cellule HDF sono state sospese in coltura cellulare, apparivano rotonde ma dopo essersi fissate nel substrato, hanno sviluppato un aspetto allungato. Gli scienziati hanno registrato i risultati di confluenza (crescita) dagli effetti combinati della semina cellulare. I risultati hanno mostrato che l'ordine orientativo si è verificato a causa di interazioni dirette tra le cellule e il substrato LCE. I substrati hanno aiutato ad allineare sia i corpi che i nuclei delle cellule HDF come una caratteristica importante per molte funzioni cellulari tra cui l'espressione proteica, motilità, metabolismo e differenziazione.

Allineamento modellato delle cellule HDF su LCE con un (-1/2, +1/2) coppia di difetti. (A) Texture PolScope che mostra nˆLCE e ritardo ottico di LCE a contatto con il mezzo di crescita cellulare. (B e C) Trame DHM della superficie LCE a contatto con il mezzo di crescita cellulare con (B) -1/2 e (C) +1/2 difetti. (D) cellule HDF colorate con fluorescenza; 4′, Nuclei di cellule marcate con 6-diamidino-2-fenilindolo (blu) e filamenti del citoscheletro di actina marcati con falloidina (verde). (E) La densità superficiale dei nuclei cellulari in funzione della distanza r da +1/2 (blu) e -1/2 (rosso) nuclei difettosi. (F) Grande numero di fluttuazioni di densità ΔN dei nuclei in prossimità dei nuclei difettosi. (G) Immagini PCM di cellule HDF su substrato LCE a 240 ore dopo la semina. I punti blu e rossi indicano la posizione di +1/2 e -1/2 nuclei difettosi, rispettivamente, ottenuto dalla tessitura di microscopia ottica polarizzata (POM) di LCE. (H) Campo orientativo con codice colore e (I) lo schema corrispondente del direttore del tessuto HDF modellato nˆHDF ripreso con PCM. Le barre rosse in (I) indicano l'orientamento locale degli assi lunghi delle celle. (J) Separation between half-strength defects for horizontal and vertical director between them (see fig. S6). Barre della scala, 300 μm. Credito:progressi scientifici, doi:10.1126/sciadv.aaz6485
The HDF cells on LCE self-organized into aligned assemblies following pre-imposed directions. The team noted the behavior of cells and cell density to vary as they approached defect cores and other topological inconsistencies (bent type defects or splay type defects) on the LCE substrates. The substrates markedly impacted the HDF cells that were in contact with each other, resulting in collectively strong differences in the size and shape of cells. The marked differences indicated the influence of the predesigned patterns on the HDF cell phenotype (size and shape). Based on additional results, Turiv et al. credited the number density fluctuations in tissues to be influenced by the surface charge of director patterns and studied the issue in detail in a larger surface area.
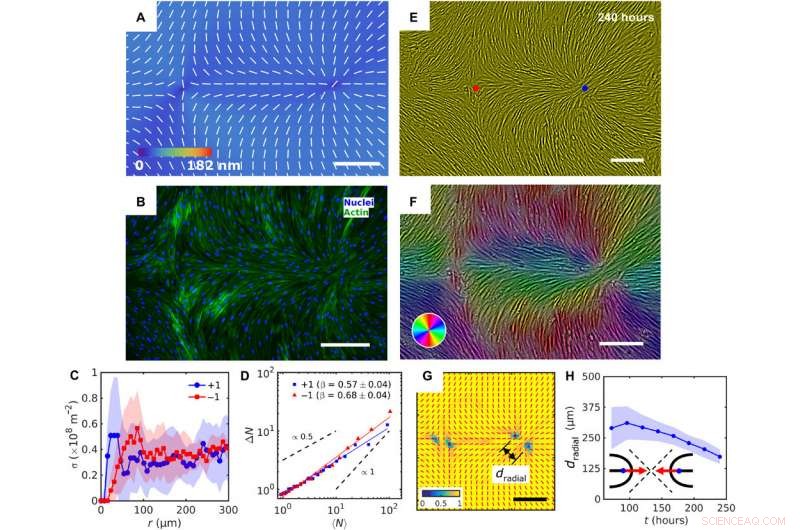
Patterned alignment of HDF cells on LCE predesigned with a pair of −1 and radial +1 (splay type) defects. (A) PolScope image of nˆLCE pattern of LCE in contact with the cell growth medium. (B) Fluorescently labeled HDF cells. (C) The surface density of cell nuclei σ as the function of distance from defect cores. (D) Large number density fluctuations ΔN with mean number of nuclei 〈N〉 showing a larger slope near −1 cores as compared to +1. (E) PCM textures of HDF cells on LCE layer at 240 hours after cell seeding. Red and blue dots denote location of −1 and +1 defects in patterned LCE obtained from crossed polarized textures. (F) Color-coded orientational field and (G) of the corresponding scheme of patterned HDF tissue director nˆHDF obtained from local anisotropy of PCM texture in (E). Red bars in (G) denote local orientation of cells’ long axes. (H) Time dependence of separation between two +1/2 defects near the +1 radial core. Barre della scala, 300 μm. Credito:progressi scientifici, doi:10.1126/sciadv.aaz6485
In questo modo, Taras Turiv and colleagues showed the dynamics and propagation of defects in patterned tissues and how they could be halted through surface anchoring forces. The scientists used LCE substrates with photopatterned structures of varying molecular orientations to grow biological tissues with predesigned cell alignment. The substrates affected cell alignment as well as cell surface density and cell phenotypes. The team noted higher density of cells in defect cores with positive topological charge, while cell density was lower near negative defects. The cells mechanistically aligned to the substrates by swelling upon contact with the aqueous cell culture medium, followed by aligning to predesigned photopatterned direction. This approach will allow materials scientists and bioengineers to design biological tissues with predetermined cell alignment and precise location of orientational defects. The outcomes can facilitate controlled cell migration, differentiation. and apoptosis. The work can be further optimized to advance the understanding of fundamental mechanisms underlying tissue development and regeneration.

The orientational order of the assemblies in +1/2 and −1/2 disclinations. Credito:progressi scientifici, doi:10.1126/sciadv.aaz6485
© 2020 Scienza X Rete