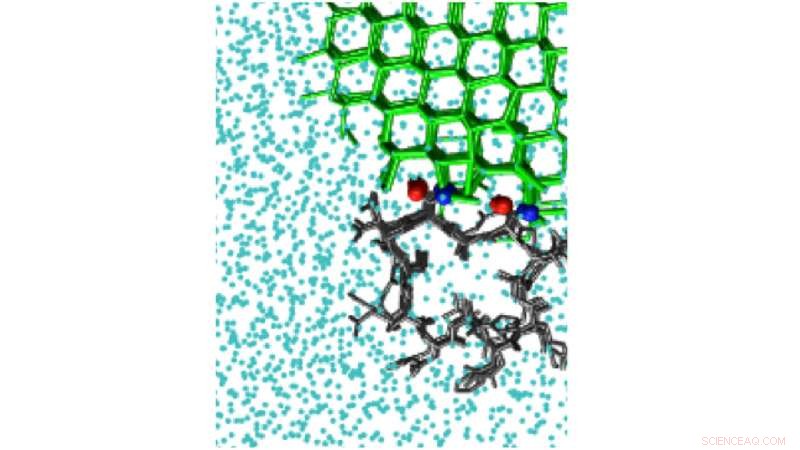
Le simulazioni di polarizzazione del ghiaccio possono rilevare il sito di legame del ghiaccio della proteina antigelo iperattiva dal coleottero Tenebrio molitor, TmAFP. Credito:Pavithra M. Naullage
Alcune molecole si legano strettamente alla superficie del ghiaccio, creando un'interfaccia curva che può fermare l'ulteriore crescita del ghiaccio. Alcuni insetti, impianti, e le creature marine contengono molecole proteiche di questo tipo che agiscono come agenti antigelo naturali, permettendo agli organismi di resistere a temperature di congelamento.
In Il Giornale di Fisica Chimica , gli scienziati segnalano un metodo computazionale per modellare il legame del ghiaccio utilizzando una tecnica di polarizzazione per guidare la formazione di ghiaccio nella simulazione.
Le proteine antigelo agiscono legandosi a un'interfaccia esistente tra ghiaccio e acqua liquida. La superficie curva risultante arresta la crescita del ghiaccio. Esistono anche molecole nucleanti di ghiaccio che catalizzano la formazione di ghiaccio dall'acqua liquida super raffreddata.
Entrambi i fenomeni richiedono la comprensione del modo in cui le molecole si legano al ghiaccio. Comprendere il legame del ghiaccio è importante per applicazioni diverse come la crioconservazione di organi e la modellazione del clima, ma finora non sono esistiti metodi computazionali per modellare in modo efficiente questo fenomeno.
"Il vantaggio centrale dell'approccio di simulazione della polarizzazione del ghiaccio è che identifica simultaneamente la superficie di legame del ghiaccio, la faccia di ghiaccio a cui si lega, e la modalità di vincolo, " ha detto l'autrice Valeria Molinero.
Gli investigatori hanno creato due tipi di modelli. Un tipo è un modello di tutti gli atomi che contiene tutti gli atomi nelle fasi liquida e ghiacciata dell'acqua, nonché nella molecola di tipo antigelo. L'altro tipo di modello studiato è chiamato modello a grana grossa, che consente di risparmiare risorse computazionali fondendo gli atomi insieme in strutture più semplici.
Lo studio ha esaminato una serie di molecole che legano il ghiaccio, compreso l'alcol polivinilico, un inibitore della ricristallizzazione del ghiaccio sintetico, oltre a proteine naturali antigelo, come quello del coleottero Tenebrio molitor. Le proteine rappresentano una sfida di simulazione, poiché hanno superfici molto piccole che legano il ghiaccio. Questo limita la dimensione del cristallo di ghiaccio che possono legare.
Alcuni sistemi possiedono più di una posizione in cui il ghiaccio può legarsi. Questo è il caso della proteina antigelo naturale nella diatomea di ghiaccio marino Frailariopsis cylindrus. Per determinare se una proteina come questa ha più di una superficie che lega il ghiaccio, IBS, gli investigatori hanno sviluppato un metodo che hanno soprannominato "cap and repeat".
"In questa strategia, abbiamo prima eseguito una simulazione distorta per rilevare un IBS. Quindi, copriamo quell'IBS per prevenire la formazione di ghiaccio su di esso ed eseguiamo una seconda simulazione di polarizzazione per scoprire se il ghiaccio si forma in altri siti, ", ha detto Molinero.
I metodi sviluppati in questo studio mostrano grandi promesse per una serie di applicazioni, compresa la ricerca di molecole per proteggere i tessuti congelati durante la conservazione, approfondire la comprensione delle proteine naturali antigelo, e nei modelli climatici, dove la nucleazione del ghiaccio nell'atmosfera gioca un ruolo chiave.