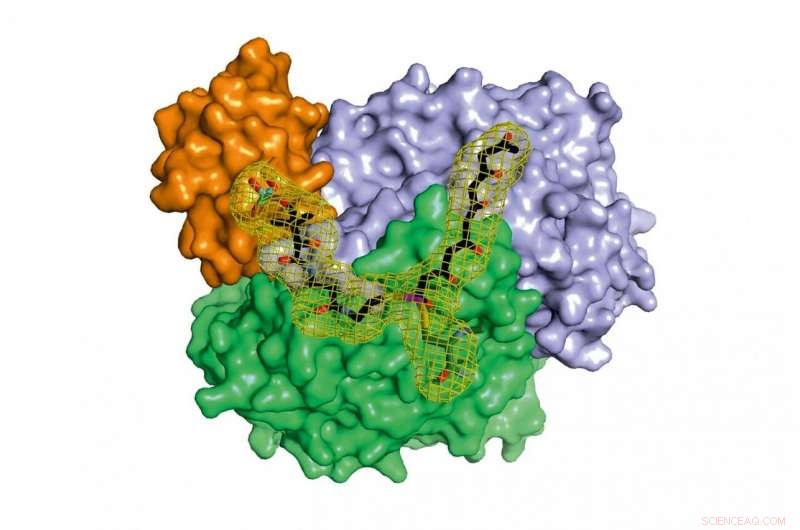
Un complesso di tre proteine protegge l'esachetide altamente reattivo quando viene esteso all'ottachetide. In collaborazione con altre proteine, importanti sostanze naturali sono prodotte dall'octaketide risultante. Crediti:Maximilian Schmalhofer e Prof. Dr. Michael Groll/TUM
I principi attivi di molti farmaci sono prodotti naturali, così chiamato perché spesso solo i microrganismi sono in grado di produrre le strutture complesse. Simile alla linea di produzione in una fabbrica, grandi complessi enzimatici mettono insieme queste molecole di agenti attivi. Un team dell'Università tecnica di Monaco (TUM) e dell'Università Goethe di Francoforte è ora riuscito a studiare i meccanismi di base di una di queste fabbriche molecolari.
Molti farmaci importanti come gli antibiotici o gli agenti attivi contro il cancro sono prodotti naturali creati da microrganismi, ad esempio batteri o funghi. In laboratorio, questi prodotti naturali spesso non possono essere prodotti affatto o solo con grande fatica. Il punto di partenza di un gran numero di tali composti sono i polichetidi, che sono catene di carbonio in cui ogni secondo atomo ha un doppio legame con un atomo di ossigeno.
In una cellula microbica come nel batterio Photorhabdus luminescens, sono prodotti con l'aiuto di polichetidi sintasi (PKS). Per costruire passo dopo passo le molecole desiderate, nella prima fase dei sistemi PKS di tipo II, quattro proteine lavorano insieme nel cambiare "squadre".
In una seconda fase, vengono quindi modificati nel prodotto naturale desiderato da ulteriori enzimi. Esempi di prodotti naturali batterici prodotti in questo modo sono, tra l'altro, gli antibiotici tetraciclici clinicamente usati o la doxorubicina, un farmaco antitumorale.
Cooperazione interdisciplinare
Mentre le fasi modificate del secondo stadio sono ben studiate per molti agenti attivi, fino ad ora non si sono avute quasi informazioni sul funzionamento generale del primo stadio di queste fabbriche molecolari in cui il prodotto intermedio polichetide altamente reattivo è legato al complesso enzimatico e protetto in modo che non possa reagire spontaneamente.
Questa lacuna è ora colmata dai risultati della cooperazione tra i gruppi di lavoro di Michael Groll, professore di biochimica presso l'Università tecnica di Monaco di Baviera, e Helge Bode, professore di biotecnologia molecolare alla Goethe University di Francoforte, che sono pubblicati nella rinomata rivista scientifica Chimica della natura .
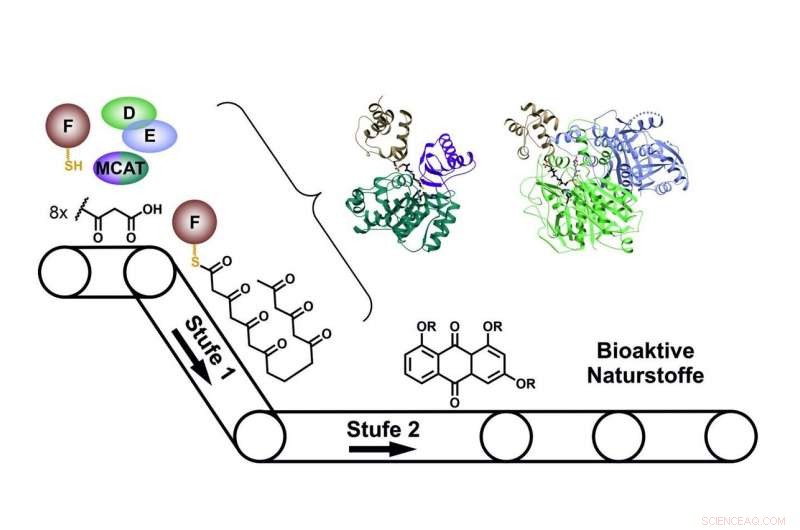
Quando si costruiscono prodotti naturali, i singoli enzimi del sistema PKS di tipo II interagiscono come le catene di montaggio di una fabbrica. Crediti:Prof. Dr. Helge Bode/Goethe-Universitaet Frankfurt
I risultati ispirano nuove sintesi di agenti attivi
"Nel contesto di questo lavoro, siamo stati per la prima volta in grado di analizzare i complessi delle diverse proteine partner della polichetide sintasi di tipo II con l'aiuto dell'analisi della struttura a raggi X e ora comprendiamo in dettaglio il ciclo catalitico completo, "Spiega Michael Groll.
"Sulla base di questi risultati, sarà possibile in futuro manipolare in modo mirato i processi biochimici centrali e quindi modificare le strutture di base invece di limitarsi agli enzimi di decorazione, " aggiunge Helge Bode.
Sebbene sia una lunga strada per sviluppare antibiotici e altri farmaci migliori, entrambi i gruppi sono ottimisti sul fatto che ora si possa spiegare anche la struttura e il meccanismo delle parti mancanti della fabbrica molecolare. "Abbiamo già dati promettenti sugli ulteriori complessi proteici, "dice Maximilian Schmalhofer, che è stato coinvolto nello studio come dottorando a Monaco di Baviera.