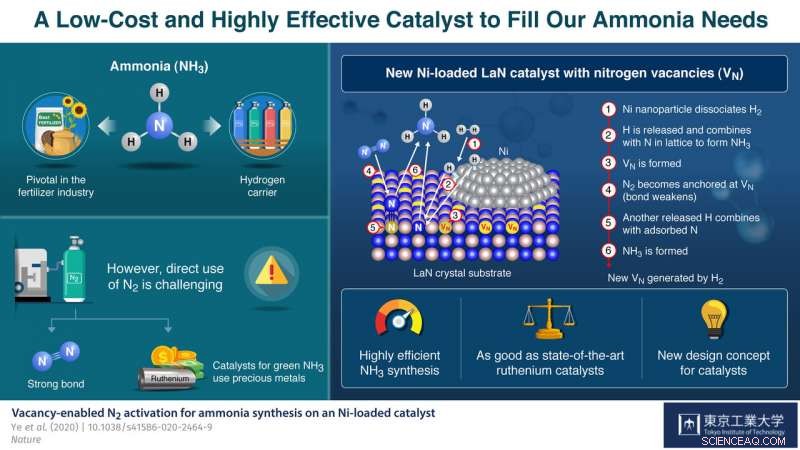
Il nitruro di lantanio caricato con nichel (LaN) consente una sintesi dell'ammoniaca stabile e altamente efficiente. Le vacanze di azoto sono generate su LaN con bassa energia di formazione, e legano e attivano efficacemente N2. Credito:Tokyo Tech
ammoniaca (NH 3 ) è una delle sostanze chimiche più comunemente prodotte al mondo, a causa del suo utilizzo come ingrediente importante in un'ampia gamma di processi di produzione industriale. Ad esempio, è fondamentale nella produzione di fertilizzanti, e oltre 150 milioni di tonnellate di esso vengono utilizzate ogni anno per aumentare i raccolti di varie colture. L'ammoniaca è prodotta naturalmente da molti organismi viventi, ma sintetizzandolo artificialmente usando azoto (N 2 ) e idrogeno (H 2 ) è impegnativo perché il forte legame tra gli atomi di N è difficile da rompere.
Mentre un metodo per produrre NH 3 su scala industriale, chiamato processo Haber-Bosch, esiste dall'inizio del XX secolo, l'approccio più performante odierno prevede l'uso di rutenio, un metallo costoso e raro, come catalizzatore per innescare le reazioni necessarie. Recentemente, Prof Hideo Hosono e colleghi del Tokyo Institute of Technology (Tokyo Tech), Giappone, hanno sviluppato una nuova strategia per produrre NH 3 usando lantanio (La), un elemento molto più abbondante, in combinazione con nichel (Ni).
Nella loro carta, pubblicato in Natura , spiegano come hanno tratto ispirazione da un NH . precedentemente riportato 3 catalizzatore di produzione con la formula Co 3 Mo 3 N, che porta posti vacanti di azoto, luoghi in cui ci si aspetterebbe la presenza di un atomo di azoto ma che in realtà sono vuoti. Questi posti vacanti sono stati osservati per rendere la scissione di N 2 molecole più facili, che ha portato la squadra di Hosono verso una nuova direzione di esplorazione per NH . più prontamente disponibile ed efficace 3 catalizzatori di sintesi. Spiega:"Il ruolo critico dei posti vacanti di azoto in Co 3 Mo 3 N ci ha ispirato a prendere in considerazione altri materiali contenenti azoto su cui è possibile generare facilmente posti vacanti come base per nuovi catalizzatori a base di Ni".
Il catalizzatore che hanno sviluppato è costituito da cristalli di LaN caricati con nanoparticelle di Ni. Il Ni dissocia facilmente H 2 in atomi di H. Così, pretrattamento del catalizzatore con H 2 genera facilmente atomi di H, che poi reagiscono con gli atomi di N nella struttura cristallina per formare NH 3 e creare N posti vacanti sul supporto LaN. Ciascuno di questi siti vuoti cattura quindi un atomo di N da un N 2 molecola dal gas azoto in ingresso, causando l'indebolimento del legame N-N della molecola. Un altro atomo di H dissociato rompe il legame N-N indebolito per produrre più NH 3 , lasciando un atomo di N per riempire il posto vacante originale. Questi cicli si ripetono, generando così continuamente vacanze di azoto e sostenendo il processo di sintesi.
Questo concetto di catalizzatore "doppio sito attivo" si è rivelato molto promettente. Le prestazioni del catalizzatore proposto superano di gran lunga quelle dei più convenzionali catalizzatori a base di cobalto e nichel ed è paragonabile anche a quello di quelli a base di rutenio:non solo produce costantemente elevate rese di ammoniaca a temperatura e pressione moderate, la sua struttura si mantiene anche dopo 100 ore di reazione continua, dimostrando la sua elevata stabilità.
Hosono dice, "Prevediamo che il nostro lavoro stimolerà un'ulteriore esplorazione di progetti di catalizzatori che utilizzano elementi più abbondanti. In particolare, i nostri risultati illustrano il potenziale dell'utilizzo di siti vacanti nei cicli di reazione e indicano un nuovo concetto di design per i catalizzatori per la sintesi dell'ammoniaca".
La nuova strategia potrebbe rendere la produzione di ammoniaca più semplice ed economica, facilitando così una moltitudine di processi industriali significativi.