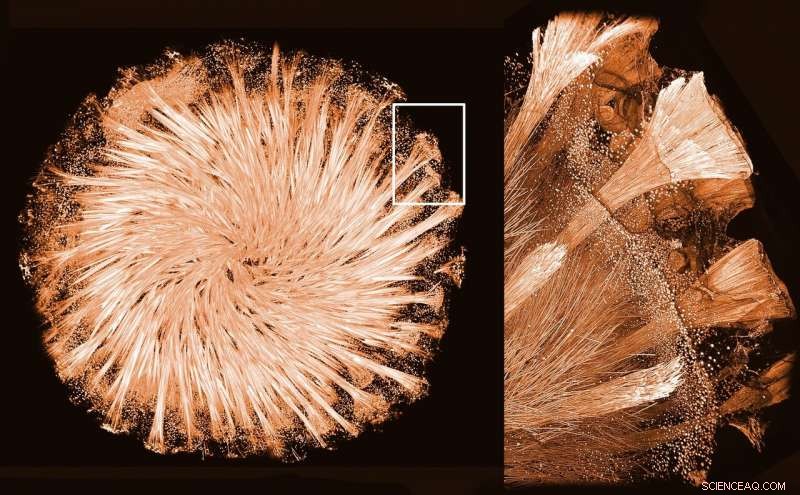
Spugna di vetro. Credito:Ronald Seidel/Igor Zlotnikov
Le spugne sono alcuni degli animali più antichi della Terra. Vivono in una vasta gamma di acque, dai laghi agli oceani profondi. Sorprendentemente, lo scheletro di alcune spugne è costituito da una rete di strutture in vetro altamente simmetriche. Queste impalcature di vetro hanno incuriosito i ricercatori per molto tempo. In che modo le spugne manipolano il vetro disordinato negli elementi scheletrici che sono così regolari? I ricercatori del B CUBE—Center for Molecular Bioengineering presso la TU Dresden, insieme ai team del Center for Advancing Electronics Dresden (cfaed) e della Swiss Light Source presso l'Istituto Paul Scherrer in Svizzera, sono i primi a determinare il tridimensionale (3-D ) struttura di una proteina responsabile della formazione del vetro nelle spugne. Spiegano come il primo e, infatti, si forma l'unico cristallo proteico-minerale naturale conosciuto. I risultati sono stati pubblicati sulla rivista PNAS .
Le spugne di vetro, come suggerisce il nome, hanno uno scheletro a base di vetro composto da una rete di aghi di vetro, ganci, stelle, e sfere. Per ottenere un'architettura così unica devono manipolare la forma del vetro disordinato per formare elementi altamente regolari e simmetrici. Fibre cristalline sottili costituite da una proteina, noto come silicateina, sono presenti nei canali all'interno di questi elementi in vetro. È noto che i cristalli di silicateina sono responsabili della sintesi del vetro nelle spugne e della formazione dello scheletro vetroso. Però, finora gli sforzi per determinare la struttura 3-D di questa proteina, descrivere come si assembla in cristalli, e come quelli che formano lo scheletro di vetro non abbiano avuto successo. Principalmente, perché nessuno è stato in grado di riprodurre questi cristalli in laboratorio.
Un team di ricercatori guidato dal Dr. Igor Zlotnikov del B CUBE –Center for Molecular Bioengineering presso TU Dresden ha provato un approccio insolito. Invece di produrre silicateina in laboratorio e cercare di ottenere cristalli cresciuti in laboratorio per studiarne la struttura, i ricercatori hanno deciso di prendere gli aghi di vetro da uno scheletro di spugna e analizzare i minuscoli cristalli che già esistono all'interno.
Il gruppo Zlotnikov, insieme ai ricercatori del Centro di nanoanalisi di Dresda (DCN) presso il Centro per l'avanzamento dell'elettronica di Dresda (cfaed), ha utilizzato la microscopia elettronica a trasmissione ad alta risoluzione (HRTEM) per dare un'occhiata più da vicino ai cristalli di silicateina confezionati all'interno degli aghi di vetro. "Abbiamo osservato una struttura eccezionalmente ordinata e allo stesso tempo complessa. Analizzando il campione abbiamo visto che si tratta di una miscela di materia organica e inorganica. Ciò significa che sia le proteine che il vetro formano una sovrastruttura ibrida che in qualche modo modella lo scheletro delle spugne. , " spiega il dottor Zlotnikov.
Un modo tradizionale per ottenere una struttura tridimensionale di una proteina consiste nell'esporre il suo cristallo a un raggio di raggi X. Ogni cristallo proteico disperde i raggi X in un modo diverso fornendo un'istantanea unica della sua disposizione interna. Ruotando il cristallo e raccogliendo tali istantanee da molte angolazioni, i ricercatori possono utilizzare metodi computazionali per determinare la struttura della proteina 3-D. Tale approccio è ampiamente utilizzato ed è alla base della moderna biologia strutturale. Funziona bene per cristalli di almeno 10 micron di dimensione. Però, il gruppo Zlotnikov voleva analizzare cristalli di silicateina che erano circa 10 volte più piccoli. Quando esposti ai raggi X sono stati quasi immediatamente danneggiati, rendendo impossibile raccogliere un set di dati completo di istantanee da più angolazioni.
Con il supporto del team della Swiss Light Source (SLS) di PSI, i ricercatori hanno utilizzato un nuovo metodo emergente noto come cristallografia seriale. "Combini immagini di diffrazione da molti cristalli, "dice Filip Leonarski, scienziati della linea di luce al PSI, chi è stato coinvolto nello studio. "Con il metodo tradizionale si gira un film. Con il nuovo metodo si ottengono molte istantanee che si combinano in seguito per decifrare la struttura". Ogni istantanea viene scattata in una parte diversa del minuscolo cristallo o anche da un cristallo diverso.
In totale, i ricercatori hanno raccolto più di 3500 istantanee di diffrazione dei raggi X individuali da 90 aghi di vetro con orientamenti completamente casuali. Utilizzando metodi computazionali all'avanguardia sono stati in grado di trovare l'ordine nel caos e assemblare i dati per determinare la prima struttura tridimensionale completa della silicateina.
"Prima di questo studio, la struttura della silicateina è stata ipotizzata in base alla sua somiglianza con altre proteine, " afferma il dottor Zlotnikov. Utilizzando la struttura 3-D appena ottenuta della silicateina, i ricercatori sono stati in grado di comprenderne l'assemblaggio e la funzione all'interno dello scheletro di vetro della spugna. Hanno costruito un modello computazionale della sovrastruttura all'interno dell'ago di vetro e hanno spiegato le immagini complesse iniziali delle sovrastrutture in vetro proteico ottenute con l'HRTEM.
"Abbiamo fornito informazioni dettagliate sull'esistenza di una sovrastruttura funzionale in vetro proteico 3-D in un organismo vivente. Infatti, quello che descriviamo è il primo assemblaggio cristallino ibrido minerale-proteina noto in natura, " conclude il dottor Zlotnikov.