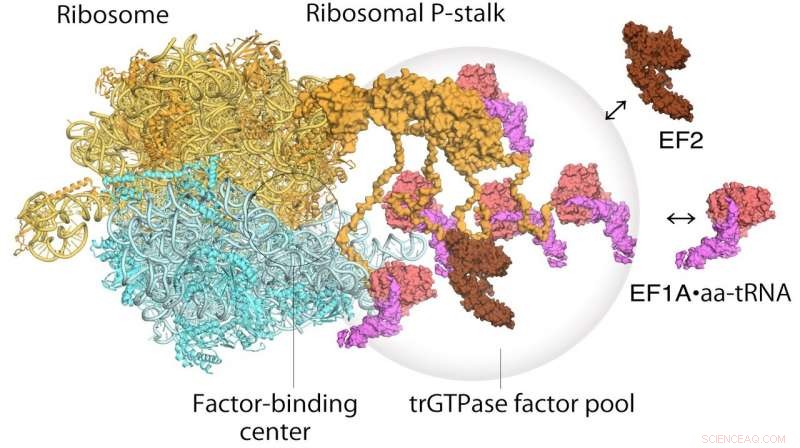
Modello di traduzione di ribosomi e fattori di allungamento. EF1A•GTP•aatRNA ed EF2 si assemblano al gambo ribosomiale sul ribosoma traslante. Il pool di fattori di traduzione contribuisce alla sintesi proteica efficiente in un ambiente intracellulare affollato. Credito: Atti dell'Accademia Nazionale delle Scienze
I ribosomi sono i complessi di ribonucleoproteine al centro della sintesi proteica nelle cellule. Però, in assenza di prove conclusive, come questi complessi operano è stato aperto al dibattito. Ora, Hirotatsu Imai e Noriyuki Kodera all'Università di Kanazawa, insieme a Toshio Uchiumi alla Niigata University in Giappone, mostrano visualizzazioni delle dinamiche strutturali e del raggruppamento dei fattori che si verificano nelle proteine del gambo dei ribosomi mentre costruiscono nuove proteine.
I ribosomi furono scoperti per la prima volta negli anni '50, e la loro ampia funzione è stata ampiamente compresa per qualche tempo:leggono sequenze di RNA messaggero, e da ciò, generare sequenze di amminoacidi correttamente ordinati in nuove proteine. La proteina del gambo ribosomiale, in particolare, svolge un ruolo fondamentale nel processo di sintesi proteica reclutando fattori proteici responsabili della traduzione e dell'allungamento della sequenza amminoacidica. Però, è stato difficile stabilire la struttura della proteina del gambo del ribosoma legato a causa della sua flessibilità. Qui, l'alta risoluzione e la rapida acquisizione delle immagini della microscopia a forza atomica ad alta velocità si è rivelata preziosa.
La microscopia a forza atomica utilizza una punta su scala nanometrica per tracciare i campioni, proprio come l'ago di un giradischi in vinile che scansiona un disco, tranne che i dettagli identificati da un microscopio a forza atomica possono avere una risoluzione su scala atomica. La versatilità della tecnica per diverse superfici era già un enorme vantaggio per gli studi biologici, ma con l'avvento della microscopia a forza atomica ad alta velocità, la tecnica è stata in grado di catturare per la prima volta processi dinamici, anche. io, Uchiumi e Kodera hanno usato la tecnica per rivelare che la proteina del gambo in realtà si ribalta tra due conformazioni, una che concorda con i modelli strutturali precedenti e una nuova conformazione completamente inaspettata.
Per quanto riguarda il funzionamento del ribosoma, un meccanismo in due fasi era stato precedentemente proposto per descrivere come l'informazione genetica viene tradotta attraverso proteine note come fattori traslazionali GTPasi. Il primo passo è il reclutamento dei fattori nel sito di legame del fattore sul gambo proteico, aumentando così la concentrazione dei fattori in quel punto, il cosiddetto factor pooling. Il secondo passo è il legame e la stabilizzazione di una GTPasi traslazionale sul centro di legame del fattore ribosomiale per catalizzare l'idrolisi della GTPasi. Dal loro studio di microscopia a forza atomica ad alta velocità, i ricercatori sono stati in grado di ottenere la prima prova visiva per il meccanismo di pooling del fattore GTPasi traslazionale dal gambo ribosomiale.
Sebbene lo studio non sia stato in grado di fornire prove conclusive dell'azione dei fattori una volta legati, i ricercatori hanno notato che i fattori sembravano essere trattenuti nelle vicinanze una volta completata l'idrolisi della GTPasi, suggerendo un potenziale ruolo della proteina gambo in ulteriori fasi della sintesi proteica. I ricercatori concludono, "Il lavoro futuro con HS-AFM fornirà ulteriori informazioni importanti per comprendere i comportamenti dinamici di questi complessi macchinari traslazionali".