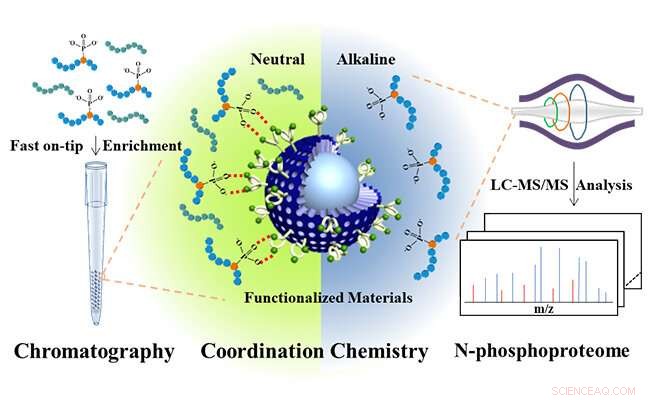
Microsfere core-shell sub-2 μm funzionalizzate con bis(zinco(II)-dipicolilammina per l'analisi dell'N-fosfoproteoma. Credito:JIANG Bo e HU Yechen
La N-fosforilazione delle proteine svolge un ruolo critico nel metabolismo centrale e nella segnalazione bi/multicomponente dei procarioti. Per di più, esiste come intermedi di alcuni importanti enzimi nei mammiferi.
Però, gli attuali metodi di arricchimento per O-fosfopeptidi non sono preferiti per N-fosfopeptidi a causa della labilità intrinseca del legame P-N in condizioni acide. Perciò, l'analisi efficace dell'N-fosfoproteoma rimane impegnativa.
Recentemente, un gruppo di ricerca guidato dal Prof. Zhang Lihua e Pro. Zhang Yukui del Dalian Institute of Chemical Physics (DICP) dell'Accademia cinese delle scienze (CAS) ha proposto una strategia di arricchimento di N-fosfopeptidi rapida ed efficace.
Il loro studio è stato pubblicato in Comunicazioni sulla natura il 4 dicembre.
Ispirato dalle fosfatasi naturali, che forniscono specifiche tasche enzimatiche centrali di Zn(II) per legare le unità fosfatiche dei substrati, i ricercatori hanno progettato bis(zinco(II)-dipicolilammina) molecolare (DpaZn) per il riconoscimento di bersagli fosfatici in condizioni neutre.
Combinando la rapida capacità di trasferimento di massa delle microsfere di silice core-shell sub-2 μm, Microsfere di silice core-shell funzionalizzate con DpaZn sub-2 μm (SiO 2 @DpaZn) sono stati progettati per l'arricchimento di N-fosfopeptidi sulla punta in condizioni neutre. In totale, 3, 384 siti N-pho, contenente 611 pHis, 1618 pLys e 1155 pArg, sono stati identificati da lisati di cellule HeLa.
Il nuovo metodo di analisi del proteoma N-fosforilato fornisce non solo dati di base per uno studio approfondito della sua funzione biologica, ma anche supporto tecnico per promuovere lo sviluppo della medicina di precisione, biologia sintetica e altri campi.