
Cristalli di AR3 osservati sotto luce polarizzata (a sinistra). Credito:Il copyright per le immagini spetta agli autori secondo i termini e le condizioni di Nature Communications
Per la prima volta, un team internazionale di ricercatori ha visualizzato la proteina fotosensibile archaerhodopsin-3 (AR3) con una risoluzione senza precedenti utilizzando le linee di luce I24 e B23 presso Diamond Light Source. Il fotorecettore è espresso da Halorubrum sodomense, un organismo che cresce nel Mar Morto, ma è meglio conosciuto per le sue applicazioni in esperimenti di optogenetica, in cui viene utilizzato per silenziare i singoli neuroni e per rilevare i cambiamenti nel voltaggio della membrana cellulare. Queste nuove strutture aprono la strada allo sviluppo di nuovi strumenti e metodologie nel campo delle neuroscienze, biologia cellulare e non solo.
Nella loro carta, pubblicato oggi in Comunicazioni sulla natura , il team riporta la prima struttura in assoluto dello stato fondamentale di AR3. In questo stato, la proteina è configurata per trasportare un H + ione attraverso la membrana cellulare per ogni fotone assorbito. Il team è stato anche in grado di cristallizzare il fotorecettore in una seconda conformazione, uno stato desensibilizzato che viene adottato da AR3 in assenza prolungata di luce.
L'autore corrispondente, il prof. Anthony Watts dell'Università di Oxford, afferma; "La superba risoluzione che abbiamo raggiunto per queste strutture AR3, 1,07 per lo stato fondamentale, è tra le più alte per una proteina di membrana wild-type depositata fino ad oggi nella Protein Data Bank. Questa qualità ci consente di visualizzare direttamente la complessa distribuzione delle molecole d'acqua all'interno del recettore e descrivere il significato funzionale delle intricate reti di legami idrogeno che formano, qualcosa che è importante in molte biomolecole, non solo nei fotorecettori. Queste reti in AR3 coinvolgono interazioni con il gruppo retinico e le catene laterali degli amminoacidi e, in questo documento, abbiamo mostrato come vengono alterati tra lo stato base e quello desensibilizzato della proteina".
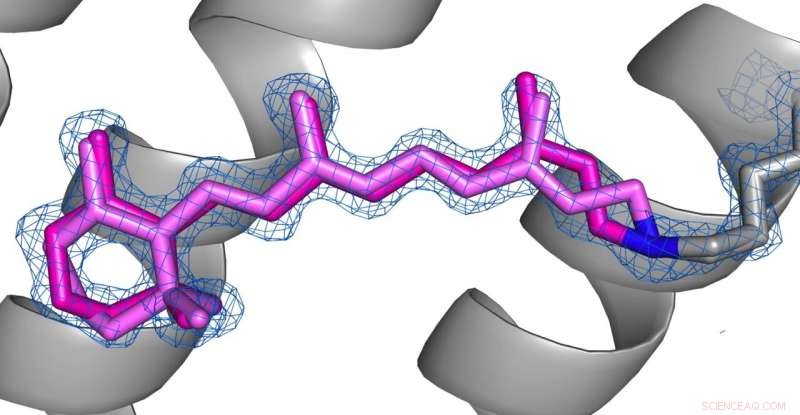
Confronto delle conformazioni della retina (rosa) allo stato desensibilizzato (fig 1) e allo stato fondamentale (fig 2) di AR3. Credito:Il copyright per le immagini spetta agli autori secondo i termini e le condizioni di Nature Communications
Spiegando il significato della proteina AR3, il dottor Juan Francisco Bada Juarez, co-autore del primo autore, commenta; "Gli entusiasmanti sviluppi dell'optogenetica nell'ultimo decennio hanno portato a un intenso interesse per l'AR3 da parte di scienziati di tutto il mondo. I mutanti della proteina vengono utilizzati abitualmente negli esperimenti di neuroscienza per silenziare selettivamente le singole cellule nervose e anche per rilevare i cambiamenti nel voltaggio transmembrana. Tuttavia , questi mutanti sono stati progettati senza conoscere la struttura della proteina stessa. I nostri dati forniscono ai biologi strutturali e agli ingegneri proteici i "progetti" per AR3 e, di conseguenza, possiamo aspettarci una significativa accelerazione nello sviluppo di nuovi strumenti optogenetici".
L'autrice co-corrispondente, la dott.ssa Isabel Moraes del National Physical Laboratory (NPL), aggiunge:
"I dati di diffrazione ad altissima risoluzione ci hanno permesso di osservare in grande dettaglio la libertà di movimento di diversi amminoacidi chiave e singole molecole d'acqua all'interno del fotorecettore. Risolvere le strutture AR3 è stato estremamente impegnativo, a causa della complessità delle caratteristiche che possiamo distinguere alla risoluzione atomica. Molte catene laterali di aminoacidi all'interno della proteina sono state risolte in più di una posizione o orientamento, indicando la loro importanza per la funzione delle proteine. La conoscenza delle dinamiche di questi gruppi è stata fondamentale per comprendere come avvengono i processi di sensibilizzazione e desensibilizzazione".
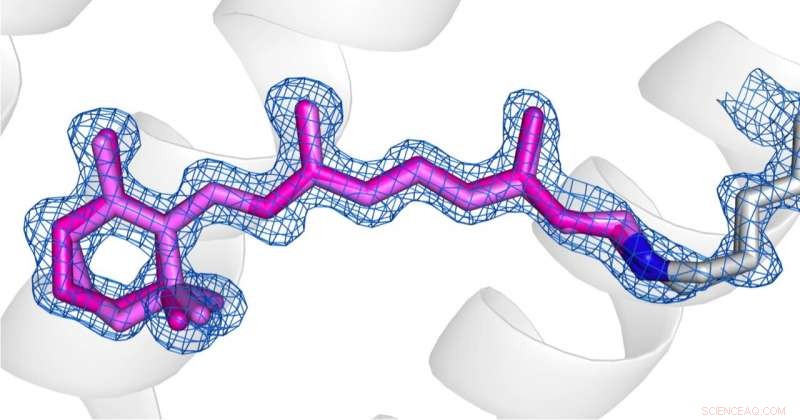
Confronto delle conformazioni della retina (rosa) allo stato desensibilizzato (fig 1) e allo stato fondamentale (fig 2) di AR3. Credito:Il copyright per le immagini spetta agli autori secondo i termini e le condizioni di Nature Communications
Essenziale per comprendere il funzionamento della proteina, erano le strutture cristalline ad alta risoluzione risolte dal team. Ottenere dati di diffrazione di così alta qualità non sarebbe stato possibile senza la linea di luce microfocus all'avanguardia della Diamond Light Source, il sincrotrone nazionale del Regno Unito, vicino a Didcot nell'Oxfordshire. Il team ha lavorato a stretto contatto con diversi esperti di Diamond.
"I microcristalli cresciuti dai team di Oxford e NPL erano perfettamente adatti alle capacità della linea di luce I24. Utilizzando il software sviluppato dal gruppo di sviluppo software DIALS di Diamond, siamo stati in grado di combinare immagini di diffrazione da più cristalli per ottenere set di dati completi. La combinazione di una precisa emissione di raggi X microfocus e di un'analisi avanzata dei dati ci ha permesso di spingere la risoluzione delle strutture risultanti ai limiti", afferma il Dr. Danny Axford, scienziato senior di Diamond Beamline.
In conclusione il Prof. Watts aggiunge:"Questo è stato uno studio affascinante. È stato un piacere lavorare con così tanti colleghi esperti sia nel Regno Unito che in tutto il mondo. Non solo ora abbiamo una conoscenza molto dettagliata delle strutture di due importanti stati funzionali di AR3, ma le intuizioni acquisite approfondiscono la nostra comprensione di come i processi di sensibilizzazione e desensibilizzazione si verificano in molte altre proteine recettrici".