© Wiley-VCH. Credito:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494
Le batterie si caricano e si ricaricano, apparentemente tutto grazie a una perfetta interazione tra materiale degli elettrodi ed elettrolita. Però, per un funzionamento ottimale della batteria, l'interfase dell'elettrolita solido (SEI) svolge un ruolo cruciale. Gli scienziati dei materiali hanno ora studiato la nucleazione e la crescita di questo strato in dettaglio atomico. Secondo lo studio pubblicato sulla rivista Angewandte Chemie , le proprietà degli anioni e delle molecole di solvente devono essere ben bilanciate.
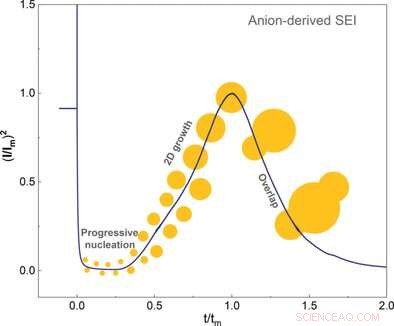
Nelle batterie agli ioni di litio, i moduli SEI all'inizio del primo processo di addebito, quando viene applicato un potenziale. Gli elementi dell'elettrolita si depositano sull'elettrodo di grafite e formano un rivestimento che presto ricopre l'intero elettrodo. Solo dopo che questo livello è stato completato, possono gli ioni di litio positivi intercalare nell'elettrodo senza esfoliare il materiale dell'elettrodo.
Qiang Zhang e colleghi della Tsinghua University, Pechino, Cina, hanno ora esaminato più da vicino la nucleazione e la crescita della SEI. L'elettrolita nelle batterie agli ioni di litio contiene sale di litio e un solvente. Solventi fortemente solvanti avvolgono lo ione di litio, e gli anioni galleggiano liberamente. In contrasto, gli elettroliti debolmente solvanti consentono un legame più stretto degli anioni allo ione litio. Qui, gli anioni rimangono parte del guscio di solvatazione interno.
Questo guscio di solvatazione interno deve essere rimosso dal litio per consentire la formazione e la crescita di SEI. I ricercatori hanno dimostrato che gli anioni del guscio interno si sono prima adsorbiti sull'elettrodo fresco e poi hanno assorbito due elettroni in una reazione elettrochimica. Quest'ultimo evento ha innescato la decomposizione e la nucleazione del SEI. Gli autori hanno concluso che la formazione di SEI dipendeva principalmente dalla facilità con cui gli anioni possono afferrare gli elettroni e decomporsi rispetto al solvente.
Gli scienziati hanno utilizzato tecniche elettrochimiche e microscopia a forza atomica per studiare la crescita dei cristalli fino al completamento dello strato. Hanno scoperto che uno strato liscio si formava solo a bassi sovratensioni. Il solvente ha anche influenzato l'iperpotenziale. Gli autori hanno anche notato che i solventi che hanno un'elevata affinità con lo strato cristallino non producono alcun potenziale eccessivo.
Hanno concluso che i futuri progetti di elettrodi ad alte prestazioni dovrebbero concentrarsi maggiormente sull'interazione tra gli ioni negativi del sale di litio e il solvente. Per consentire un inorganico omogeneo, SEI cristallino da formare, gli anioni dovrebbero superare il solvente; dovrebbero adsorbire più facilmente alla superficie dell'elettrodo e intraprendere reazioni elettrochimiche. Inoltre, i prodotti di decomposizione devono essere solidi e insolubili, ma mostrano ancora una certa affinità con il solvente, hanno detto gli autori.