Credito:Oak Ridge National Laboratory
Mentre tutti i virus hanno qualche mezzo per combattere il sistema immunitario del corpo, gli scienziati hanno studiato come il coronavirus SARS-CoV-2, la causa della pandemia globale COVID-19, può eludere il sistema immunitario negli esseri umani.
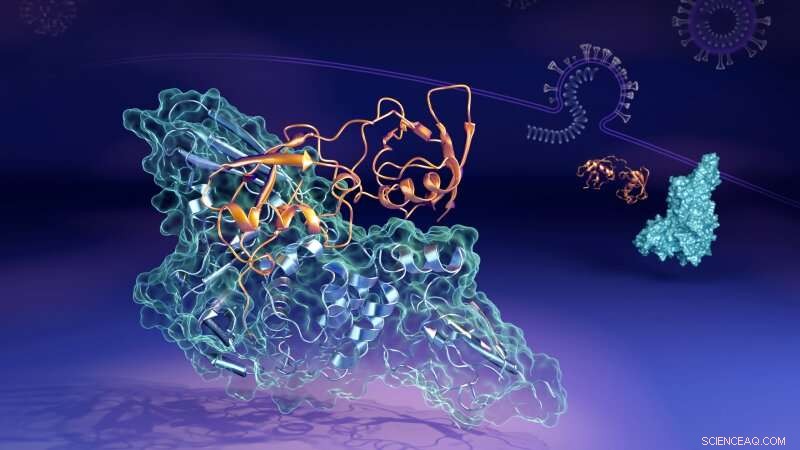
Ora gli scienziati che lavorano presso l'Oak Ridge National Laboratory (ORNL) del Dipartimento dell'Energia degli Stati Uniti (DOE) hanno rivelato i dettagli molecolari di come una proteina chiave (la proteasi simile alla papaina, o "PLpro") dal virus si collega per formare una struttura accoppiata, o "complesso, " con una proteina umana denominata gene 15 stimolato dall'interferone (ISG15). PLpro rimuove l'ISG15 da altre proteine cellulari umane per aiutare SARS-CoV-2 a eludere la risposta immunitaria. Comprendere come interagiscono le due proteine potrebbe aiutare nello sviluppo di trattamenti farmacologici terapeutici che prevenire la sua formazione e consentire al sistema immunitario di una persona di combattere meglio il virus invasore.
I risultati della ricerca, intitolato "Dinamica conformazionale nell'interazione della proteasi simile alla papaina SARS-CoV-2 con la proteina del gene 15 stimolata dall'interferone umano, " sono stati pubblicati nel Journal of Physical Chemistry Letters .
"Nelle cellule umane che il virus ha infettato, il PLpro del virus SARS-CoV-2 tende a cercare e legarsi alla proteina ISG15, un componente chiave della risposta immunitaria delle cellule, " disse Hugh O'Neill, capo del gruppo Bio-Facilities dell'ORNL e direttore del Centro di biologia molecolare strutturale del laboratorio. "Quando PLpro si lega a ISG15, fa sì che l'ISG15 cambi forma. La scoperta chiave è che l'ISG15 può assumere più forme quando si lega a PLpro."
Utilizzando lo scattering di neutroni a piccolo angolo (SANS) presso il reattore ad isotopi ad alto flusso di ORNL (HFIR), i ricercatori sono stati in grado di studiare i cambiamenti nel complesso mentre si verificavano.
"Abbiamo migliorato il contrasto tra PLpro e ISG15 preparando PLpro in cui molti degli atomi di idrogeno sono stati sostituiti con atomi di deuterio, "ha detto Kevin Weiss, un esperto in biodeuterazione. "I neutroni interagiscono in modo diverso con gli atomi di deuterio, quindi questo ci ha aiutato a differenziare meglio tra le due proteine.
"Abbiamo usato i neutroni per analizzare il complesso in soluzione, che simula meglio l'ambiente fisiologico reale del corpo umano, " disse Leighton Coates, responsabile scientifico e tecnologico dei sistemi strumentali per la seconda stazione di destinazione dell'ORNL. "Questo ci ha permesso di studiare le mutevoli forme del complesso, che altre tecniche non avrebbero potuto raccogliere."
"Le informazioni che abbiamo ottenuto dai nostri esperimenti aumentano la nostra conoscenza di come funziona il virus e ci consentiranno di costruire modelli di computer più accurati che altri scienziati potranno usare, " disse Wellington Leite, autore principale e ricercatore postdottorato ORNL. "I ricercatori saranno in grado di utilizzare il modello per cercare rapidamente i siti sull'ISG15 a cui si collega il PLpro e quindi provare a bloccarli".
Susan Tsutakawa, uno scienziato del personale biochimico presso il Lawrence Berkeley National Laboratory (Berkeley Lab), ha ottenuto dati di scattering di raggi X a piccolo angolo (SAXS) sul complesso PLpro-ISG15 presso l'Advanced Light Source Synchrotron del Berkeley Lab. "Negli studi SAXS, potremmo separare diversi complessi nel campione accoppiando SAXS con cromatografia ad esclusione dimensionale e allo stesso tempo, ottenere dati a risoluzione più elevata della configurazione complessiva del complesso, per completare gli studi SANS che hanno rivelato le conformazioni dei singoli componenti nel complesso, " disse Tsutakawa.
Il team prevede di condurre ulteriori esperimenti su questo tipo di complesso biologico per esaminare come piccole molecole possono bloccare il legame di PLpro a ISG15.