Astratto grafico. Credito:DOI:10.1038/s41589-021-00844-0
Nonostante i notevoli progressi della medicina negli ultimi anni, la fibrosi cistica rimane la malattia genetica letale più diffusa. È dovuto a mutazioni nella proteina CFTR che è normalmente necessaria per mantenere un corretto equilibrio dei fluidi in organi chiave come polmoni, pancreas o dell'apparato digerente.
Nella maggior parte dei casi, la mutazione causale, chiamato F508del, coinvolge solo uno dei 1.480 aminoacidi che compongono la proteina CFTR. Questo cambiamento apparentemente minore porta a forti effetti deleteri nella proteina, che diventa incapace di svolgere la sua normale funzione biologica, determinando l'insorgere della malattia. Per anni, i ricercatori hanno cercato di capire come e perché una semplice mutazione innesca effetti così grandi sulla struttura e sulla funzione delle proteine, con conseguenze drammatiche per i pazienti.
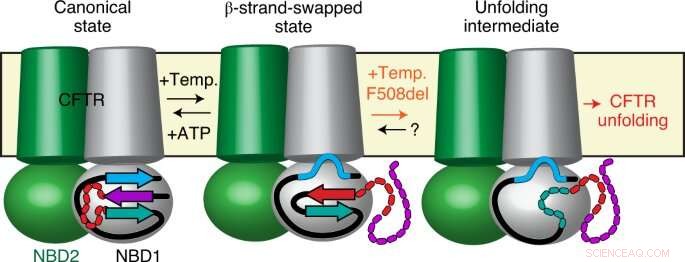
Utilizzando una combinazione di metodi all'avanguardia come la fluorescenza a singola molecola, Cristallografia a raggi X, scambio idrogeno-deuterio ed elettrofisiologia delle singole molecole, ricercatori guidati da Cédric Govaerts—Laboratoire Structure &Fonction des membranes biologiques, Facoltà di Scienze, Université libre de Bruxelles—hanno scoperto un fenomeno completamente nuovo in CFTR:mentre ci si aspetta che le proteine adottino un'unica conformazione che abilita una singola funzione biologica, hanno osservato una nuova conformazione di CFTR.
Questa struttura non era stata osservata prima e dimostra che CFTR non è una molecola fissa ma può alternare (almeno) due diverse conformazioni con funzioni potenzialmente diverse.
Sorprendentemente, i ricercatori hanno anche osservato che la mutazione più diffusa, F508del, non intacca le strutture stesse, ma piuttosto le transizioni tra di loro. In altre parole, propongono che le mutazioni che causano malattie come F508del non possano, come precedentemente creduto, perturbare la conformazione finale della proteina ma, piuttosto la dinamica, in particolare la capacità della proteina di scambiare tra diversi stati all'interno della cellula.
Questa osservazione cambia la nostra comprensione della biologia CFTR e della fibrosi cistica. Inoltre, il suo fenomeno potrebbe applicarsi ad altre proteine e quindi consentire di comprendere altre malattie genetiche.