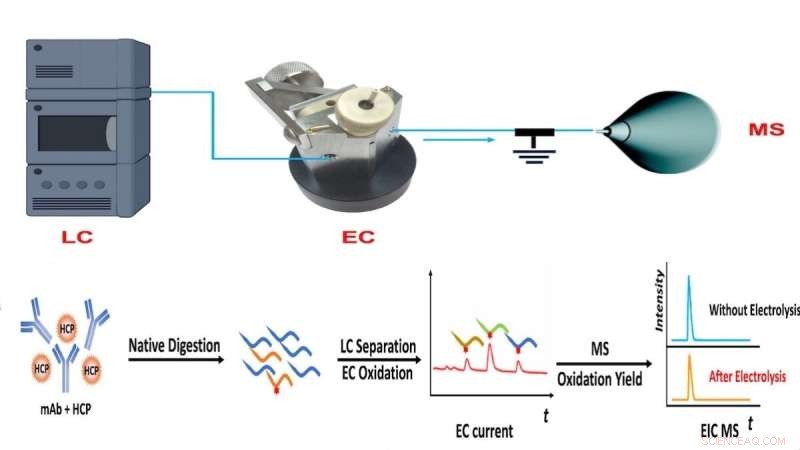
Flusso di lavoro del metodo CMS del team NJIT, che combina cromatografia liquida (LC), ossidazione elettrochimica (EC) e misurazione quantitativa dell'abbondanza proteica basata sulla spettrometria di massa (MS). Credito:NJIT
I ricercatori del New Jersey Institute of Technology (NJIT) hanno svelato una nuova tecnica di laboratorio che, secondo loro, rappresenta un "cambiamento di paradigma" nel modo in cui i laboratori farmaceutici testano e producono nuovi farmaci a base di proteine, come gli anticorpi monoclonali terapeutici sviluppati per trattare una varietà di malattie, dai tumori alle malattie infettive.
I ricercatori affermano che il loro approccio basato sull'elettrochimica, descritto nella rivista Chimica analitica , potrebbe consentire di eseguire test di sicurezza e qualità di bioterapici emergenti in una frazione del tempo richiesto dai metodi convenzionali, che in genere richiedono la produzione lunga e costosa di determinati biomateriali utilizzati per i test su campioni.
Lo studio è stato condotto in collaborazione con ricercatori della Merck, Johnson &Johnson e della Ohio University.
"Questo metodo che abbiamo sviluppato in NJIT ha il potenziale per avere un impatto importante nella proteomica quantitativa e rappresenta un cambio di paradigma nell'industria farmaceutica in termini di monitoraggio delle impurità di prodotti e processi biofarmaceutici per il controllo della qualità", ha affermato Hao Chen, autore corrispondente e professore presso il Dipartimento di Chimica e Scienze Ambientali del NJIT.
"Con questo studio, abbiamo ora dimostrato un approccio in grado di quantificare le impurità di prodotti farmaceutici e di processo molto più rapidamente e accuratamente di quanto fosse stato possibile... Ci aspettiamo che diventi molto utile per facilitare lo sviluppo di proteine e vaccini terapeutici per il trattamento e la prevenzione di malattie diverse in futuro".
Tradizionalmente, tali test, o quantificazione delle proteine, implicano la preparazione dispendiosa in termini di tempo di peptidi sintetici marcati con isotopi che vengono utilizzati come standard interni per misurare le concentrazioni proteiche totali in un campione, aiutando i ricercatori a monitorare attivamente l'efficacia e la sicurezza dei componenti proteici terapeutici durante lo sviluppo del farmaco processo.
Per superare questa limitazione, il laboratorio di Chen ha sviluppato un approccio di spettrometria di massa coulometrica (CMS) per la quantificazione assoluta delle proteine senza l'uso di standard. Il metodo applica invece la cromatografia liquida-spettrometria di massa e una cella a flusso elettrochimica per quantificare e rilevare rapidamente i cambiamenti nelle proteine o nei peptidi target in base alle firme elettrochimiche.
"Invece di aspettare settimane per ottenere standard o reagenti con approcci tradizionali, è possibile eseguire subito esperimenti di quantificazione CMS. Pertanto, faciliterebbe il tracciamento delle impurità dei farmaci scoperte durante il processo e garantirebbe la loro eliminazione efficace con l'ottimizzazione e il controllo del processo", ha affermato Chen.
"Un tale apparato ci consente di separare i peptidi dopo la digestione delle proteine con cromatografia liquida, monitorare l'ossidazione dei peptidi nella cella a flusso elettrochimica per produrre una corrente elettrica e misurare la resa di ossidazione con la spettrometria di massa", ha spiegato il primo autore dell'articolo e Ph.D NJIT . studente Yongling Ai. "La combinazione di segnali di corrente elettrica e la resa di ossidazione fornisce informazioni sufficienti per la quantificazione assoluta di peptidi e proteine".
Nel loro studio, il team ha dimostrato il suo metodo CMS ottenendo la quantificazione assoluta di più proteine (β-lattoglobulina B, α-lattoalbumina e anidrasi carbonica) in una miscela in una corsa, senza utilizzare alcuno standard.
In particolare, il team ha anche mostrato le capacità del metodo di rilevare la deammidazione proteica, un evento di degradazione comune nelle proteine terapeutiche risultante da stress fisici o chimici durante il processo di produzione e conservazione.
Il team ha quantificato con successo diversi prodotti di degradazione delle proteine, incluso un intermedio chiave della degradazione delle proteine, la formazione di succinimide, che non è mai stato fatto prima con una quantificazione assoluta a causa della mancanza di standard, secondo gli autori dello studio.
"La mancanza di standard è causata dalle sfide nella loro sintesi de novo", ha affermato Chen. "Essere in grado di quantificare accuratamente i prodotti e gli intermedi della deamimidazione potrebbe fornire una migliore comprensione della degradazione terapeutica delle proteine e potenzialmente creare un nuovo modo per indagare sulle patologie patologiche e sui processi di invecchiamento".
Ora, il laboratorio di Chen prevede di applicare il nuovo metodo per la quantificazione su larga scala di migliaia di proteine in un'unica analisi. Hanno inoltre in programma di migliorare la sensibilità della loro analisi CMS per consentire di quantificare livelli molto bassi di proteine in campioni biologici complessi, il che potrebbe avvantaggiare sforzi di ricerca che vanno dalla diagnostica clinica e la scoperta di farmaci alla medicina di precisione per la quale identificazione e quantificazione dei campioni a livello molecolare è necessario.
"Poiché le proteine svolgono una vasta gamma di funzioni all'interno degli organismi, l'importanza della quantificazione assoluta delle proteine è difficile da sopravvalutare", ha affermato Chen. "Il CMS dovrebbe accelerare i processi per la diagnosi delle malattie, la scoperta e lo sviluppo di farmaci e ora apre una nuova porta per biologi e biochimici per esplorare quantità di proteine nel corpo umano che possono svolgere importanti funzioni biologiche o ruoli come biomarcatori di malattie e bersagli farmacologici. " + Esplora ulteriormente