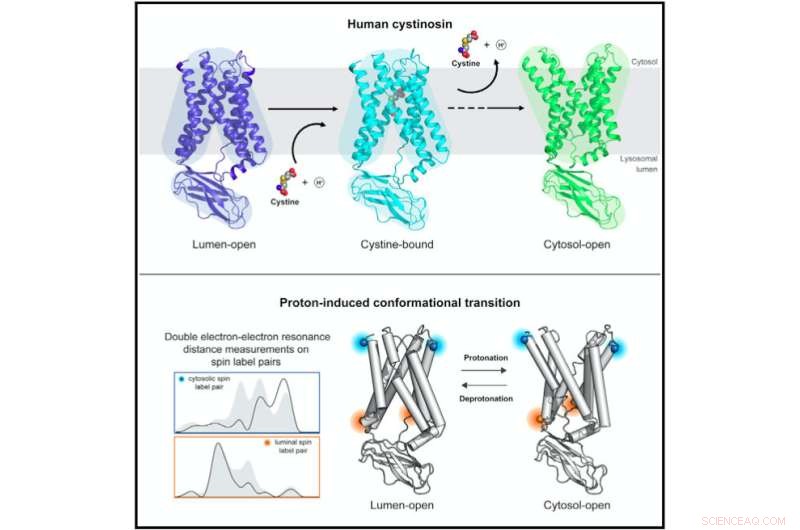
Studi strutturali e biofisici della cistinsina umana rivelano meccanismi molecolari e dinamiche conformazionali nel trasporto di aminoacidi lisosomiale accoppiato a protoni. Credito:Guo et al., Cell 2022
La rara malattia genetica cistinosi è causata da mutazioni nel gene di una proteina chiamata cistinina. Un team di scienziati ha ora risolto la struttura della cistinsina e determinato in che modo le mutazioni interferiscono con la sua normale funzione, fornendo informazioni sui meccanismi sottostanti e suggerendo un modo per sviluppare nuovi trattamenti per la malattia.
Il nuovo studio, pubblicato il 15 settembre su Cell , ha coinvolto uno sforzo collaborativo di ricercatori dell'UC Santa Cruz, della Stanford University e del Southwestern Medical Center dell'Università del Texas, che hanno unito le loro competenze in tre metodi specializzati per lo studio della struttura e della funzione delle proteine:cristallografia a raggi X, microscopia elettronica criogenica (crio- EM) e la risonanza doppia elettrone-elettrone (DEER).
"Questo documento potrebbe stabilire un modello su come combinare queste tre aree, insieme ai test biochimici, per restringere rapidamente il modo in cui una proteina funziona e identificare una strategia terapeutica", ha affermato Glenn Millhauser, illustre professore e cattedra di chimica e biochimica presso l'UC Santa Cruz e un corrispondente autore dell'articolo.
La cistinosina è una proteina trasportatrice specializzata che svolge un ruolo cruciale nel modo in cui le cellule gestiscono l'amminoacido essenziale cisteina. Le cellule riciclano costantemente le proteine, scomponendole nei loro amminoacidi costituenti per utilizzarle nella costruzione di nuove proteine. I trasportatori come la cistinsina spostano gli amminoacidi dai lisosomi, i compartimenti cellulari in cui le proteine vengono scomposte, nella cellula per essere riutilizzati. Quando la cistinina non funziona correttamente a causa di mutazioni, una forma di cisteina (un dimero chiamato cistina) si accumula all'interno dei lisosomi.
L'accumulo anomalo di cistina provoca danni diffusi a tessuti e organi e può portare a insufficienza renale, atrofia muscolare e altri problemi.
"È una malattia rara, ma può essere mortale", ha detto Millhauser. "Se non viene trattata, le persone con cistinosi di solito muoiono all'età di dieci anni."
La cistinosina assume diverse conformazioni quando è aperta all'interno del lisosoma per caricare la cistina e quando è aperta all'esterno per rilasciare cistina. I team di ricerca di Stanford (guidati dal professor Liang Feng) e UT Southwestern (guidati dal professor Xiaochun Li) hanno risolto le strutture della cistinsina in queste diverse conformazioni strutturali utilizzando la cristallografia a raggi X e la crio-EM.
La comprensione dei cambiamenti strutturali della cistinsina attraverso il processo di trasporto, tuttavia, ha richiesto gli studi DEER eseguiti dal laboratorio di Millhauser. DEER è una tecnica specializzata di risonanza magnetica che può essere utilizzata per determinare come una proteina cambia la sua forma.
"Con ciò siamo stati in grado di capire il meccanismo che consente alla cistinsina di passare da uno stato all'altro e potremmo restringere il campo su quale degli aminoacidi della proteina stesse guidando la transizione", ha detto Millhauser. "Ora possiamo vedere come le mutazioni stanno cambiando la capacità della proteina di cambiare forma e pompare la cistina fuori dal lisosoma".
Queste nuove intuizioni sulla meccanica molecolare dell'attività di trasporto della cistinosi non solo forniscono una comprensione più dettagliata della patogenesi della cistinosi, ma suggeriscono anche una possibile strategia terapeutica per trattare la malattia. "Potrebbe essere possibile migliorare l'attività di trasporto della cistinsina sviluppando piccole molecole selettive per la conformazione o agenti biologici che favoriscono una conformazione aperta al citosol", hanno scritto gli autori.
Un approccio simile potrebbe essere utilizzato per colpire altre proteine trasportatrici, che sono coinvolte in un'ampia gamma di malattie. + Esplora ulteriormente