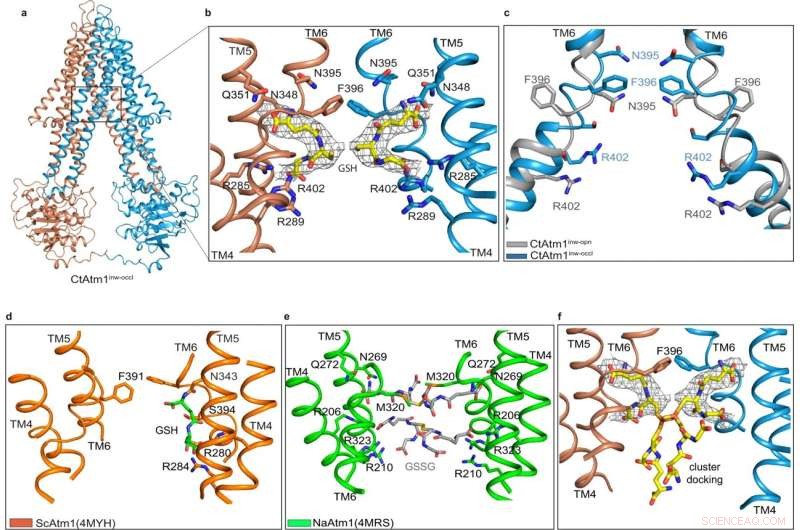
La struttura parzialmente occlusa rivolta verso l'interno con carico legato. Credito:Comunicazioni sulla natura (2022). DOI:10.1038/s41467-022-32006-8
Una nuova ricerca fornisce nuove informazioni su come un'importante classe di molecole viene creata e spostata nelle cellule umane.
Per anni, gli scienziati sapevano che i mitocondri, strutture specializzate all'interno delle cellule del corpo che sono essenziali per la respirazione e la produzione di energia, erano coinvolti nell'assemblaggio e nel movimento dei cofattori ferro-zolfo, alcuni dei composti più essenziali nel corpo umano. Ma fino ad ora, i ricercatori non capivano come funzionasse esattamente il processo.
Nuova ricerca, pubblicata sulla rivista Nature Communications , hanno scoperto che questi cofattori vengono spostati con l'aiuto di una sostanza chiamata glutatione, un antiossidante che aiuta a prevenire alcuni tipi di danni cellulari trasportando questi cofattori essenziali del ferro attraverso una barriera di membrana.
Il glutatione è particolarmente utile in quanto aiuta a regolare i metalli come il ferro, che viene utilizzato dai globuli rossi per produrre l'emoglobina, una proteina necessaria per aiutare a trasportare l'ossigeno in tutto il corpo, ha affermato James Cowan, coautore dello studio e illustre professore universitario emerito in chimica e biochimica presso l'Ohio State.
"I composti del ferro sono fondamentali per il corretto funzionamento della biochimica cellulare e il loro assemblaggio e trasporto è un processo complesso", ha affermato Cowan. "Abbiamo determinato come una specifica classe di cofattori del ferro viene spostata da un compartimento cellulare all'altro mediante l'uso di complessi macchinari molecolari, consentendo loro di essere utilizzati in più fasi della chimica cellulare".
I cluster ferro-zolfo sono un'importante classe di composti che svolgono una varietà di processi metabolici, come aiutare a trasferire gli elettroni nella produzione di energia e produrre metaboliti chiave nella cellula, oltre ad assistere nella replicazione delle nostre informazioni genetiche.
"Ma quando questi cluster non funzionano correttamente, o quando le proteine chiave non riescono a ottenerli, accadono cose brutte", ha detto Cowan.
Se incapace di funzionare, la proteina corrotta può dare origine a diverse malattie, tra cui rare forme di anemia, l'atassia di Friedreich (un disturbo che provoca un danno progressivo del sistema nervoso) e una moltitudine di altri disturbi metabolici e neurologici.
Quindi, per studiare come funziona questo meccanismo essenziale, i ricercatori hanno iniziato prendendo un fungo chiamato C. thermophilum, identificando la molecola proteica chiave di interesse e producendo grandi quantità di quella proteina per la determinazione strutturale. Lo studio rileva che la proteina che hanno studiato all'interno di C. thermophilum è essenzialmente un gemello cellulare della proteina umana ABCB7, che trasferisce i cluster ferro-zolfo nelle persone, rendendolo il campione perfetto per studiare l'esportazione di cluster ferro-zolfo nelle persone.
Utilizzando una combinazione di microscopia crioelettronica e modellazione computazionale, il team è stato quindi in grado di creare una serie di modelli strutturali che descrivono in dettaglio il percorso utilizzato dai mitocondri per esportare i cofattori di ferro in diverse posizioni all'interno del corpo. Sebbene le loro scoperte siano vitali per saperne di più sugli elementi costitutivi di base della biochimica cellulare, Cowan si è detto entusiasta di vedere come la loro scoperta potrebbe in seguito far progredire la medicina e la terapia.
"Capendo come questi cofattori vengono assemblati e spostati nelle cellule umane, possiamo gettare le basi per determinare come prevenire o alleviare i sintomi di alcune malattie", ha affermato. "Possiamo anche usare quella conoscenza fondamentale come base per altri progressi nella comprensione della chimica cellulare". + Esplora ulteriormente