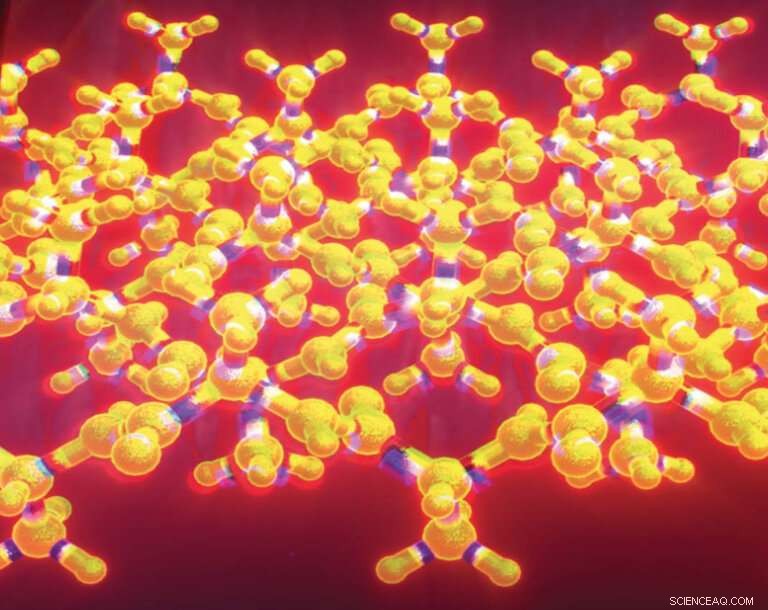
Il foglio beta increspato è una variazione del foglio beta pieghettato, un noto motivo strutturale che si trova in migliaia di proteine. Linus Pauling e Robert Corey descrissero il foglio beta increspato nel 1953, ma rimase una struttura in gran parte teorica per decenni. Gli scienziati hanno ora creato fogli ondulati in laboratorio e caratterizzato la struttura utilizzando la cristallografia a raggi X. Credito:J. Raskatov
Un'insolita struttura proteica nota come "foglio beta increspato", prevista per la prima volta nel 1953, è stata ora creata in laboratorio e caratterizzata in dettaglio utilizzando la cristallografia a raggi X.
Le nuove scoperte, pubblicate a luglio su Chemical Science , può consentire la progettazione razionale di materiali unici basati sull'architettura del foglio ondulato.
"Il nostro studio stabilisce la configurazione dello strato increspato del foglio beta come motivo con caratteristiche generali e apre la strada alla progettazione basata sulla struttura di architetture molecolari uniche, con potenziale per lo sviluppo di materiali e applicazioni biomediche", ha affermato Jevgenij Raskatov, professore associato di chimica e biochimica presso l'UC Santa Cruz e corrispondente autore dell'articolo.
Le proteine sono disponibili in una vasta gamma di forme e dimensioni per svolgere la loro miriade di ruoli strutturali e funzionali nelle cellule viventi. Alcuni motivi strutturali comuni, come l'alfa elica, si trovano in molte strutture proteiche.
Il foglio increspato è una variazione del foglio beta pieghettato, un noto motivo strutturale che si trova in migliaia di proteine. Linus Pauling e Robert Corey descrissero il foglio beta increspato nel 1953, due anni dopo aver introdotto il concetto di foglio beta a pieghe. Mentre il foglio beta pieghettato è ben noto e spesso chiamato semplicemente il foglio beta, il foglio increspato è rimasto una struttura in gran parte teorica per decenni.
In uno studio precedente pubblicato su Scienze chimiche nel 2021, il team di Raskatov ha riferito di aver ottenuto una struttura del foglio beta increspato mescolando un piccolo peptide con quantità uguali della sua immagine speculare. I ricercatori hanno utilizzato forme speculari di trifenilalanina, un breve peptide costituito da tre aminoacidi della fenilalanina. I peptidi dell'immagine speculare si sono uniti a coppie per formare "dimeri" con la struttura prevista, ma non hanno formato la topografia estesa e periodica dello strato beta increspato ipotizzata da Pauling e Corey.
"I dimeri si sono raggruppati in strutture di strati a spina di pesce, il che ha sollevato dubbi sulla fattibilità della configurazione periodica dello strato beta increspato", ha affermato Raskatov.
Nel nuovo studio, i ricercatori hanno sostituito altri amminoacidi con una delle trifenilalanine per creare tripeptidi leggermente diversi e le loro immagini speculari. Usando questi nuovi tripeptidi, sono stati in grado di creare tre diversi sistemi peptidici di aggregazione che formavano strati di fogli beta ondulati antiparalleli estesi, in cui i filamenti peptidici a immagine speculare erano disposti in modo alternato. I risultati della cristallografia a raggi X hanno mostrato che le strutture cristalline sono in eccellente accordo generale con le previsioni fatte da Pauling e Corey. + Esplora ulteriormente