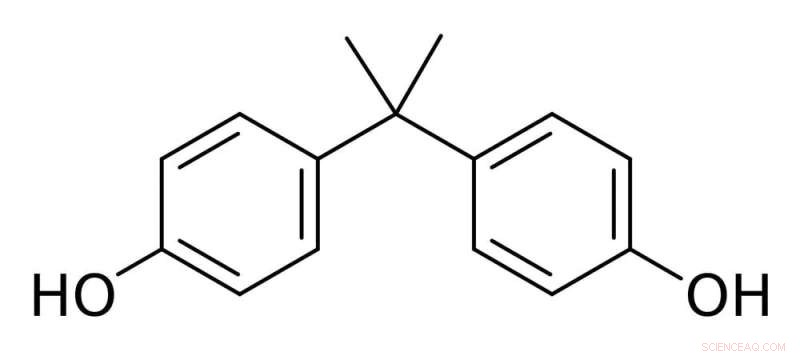
Il bisfenolo A è costituito da due anelli di carbonio con piccoli gruppi alcolici attaccati e viene utilizzato per produrre plastiche resistenti e trasparenti. Credito:Darkness3560/Wikimedia Commons
Il bisfenolo A, o BPA, è una sostanza chimica ampiamente utilizzata per produrre plastiche dure e trasparenti. È un distruttore endocrino che è stato collegato a molti effetti negativi sulla salute, tra cui malattie cardiovascolari e diabete. Nel 2013, il governo degli Stati Uniti ne ha vietato l'uso nei prodotti per l'infanzia che vengono a contatto con gli alimenti, come i biberon o il confezionamento di alimenti per lattanti.
A quel tempo, la Food and Drug Administration statunitense concluse che una certa esposizione era sicura per gli adulti. Ma altre agenzie sanitarie, inclusa l'Autorità europea per la sicurezza alimentare, hanno concluso che i livelli di BPA che la FDA considera sicuri possono avere effetti negativi sulla salute anche per gli adulti.
All'inizio di giugno 2022, la FDA ha segnalato che sta riconsiderando la quantità di esposizione al BPA sicura per gli adulti, annunciando che avrebbe riconsiderato le sue linee guida sull'uso del BPA nelle materie plastiche a contatto con gli alimenti.
Come chimico di polimeri sintetici, penso molto a come progettare nuovi polimeri, con particolare attenzione a come farlo in modo sostenibile. È naturale chiedersi perché le aziende non sostituiscono semplicemente il BPA con un'altra sostanza chimica se la salute è una tale preoccupazione. Il segreto di ciò che rende il BPA un ingrediente così insostituibile nella plastica è la stessa cosa che porta ai suoi rischi per la salute:la struttura chimica della molecola.
Cos'è il BPA?
Il BPA è una piccola molecola composta da due anelli di carbonio con un legame di ossigeno e idrogeno attaccato a entrambe le estremità. Il BPA può reagire con altre molecole a base di carbonio per formare lunghe catene, con le molecole di BPA unite insieme da piccoli legami chimici.
Quasi tutto il BPA prodotto nel mondo viene utilizzato per produrre plastica, principalmente un tipo specifico chiamato policarbonato. I policarbonati derivati dal BPA sono trasparenti, incredibilmente resistenti, leggeri e non iniziano a sciogliersi o a perdere integrità strutturale fino a quando non raggiungono temperature molto elevate. Queste proprietà rendono i policarbonati particolarmente adatti per l'uso in qualsiasi cosa, dalle lenti degli occhiali alle bottiglie d'acqua.
Riguarda la struttura
In chimica, struttura significa tutto. Il motivo per cui materiali diversi hanno proprietà diverse è dovuto alla loro struttura chimica.
I polimeri BPA sono rigidi perché gli anelli di carbonio nelle molecole di BPA sono essi stessi rigidi. Confrontalo con il polietilene, il materiale sottile e flessibile utilizzato per realizzare i sacchetti di plastica. Le lunghe catene di molecole ripetitive che compongono il polietilene sono molto flessibili. Quindi anche la plastica che producono sono altamente flessibili.
In che modo i BPA vengono filtrati dalla plastica?
Quando viene prodotta la plastica BPA, quasi tutte le singole molecole di BPA sono legate chimicamente alla plastica. Quindi la maggior parte del BPA che fuoriesce dai contenitori per alimenti o dalle bottiglie d'acqua deriva dalla lenta rottura della plastica.
Quando i policarbonati BPA sono esposti all'acqua e al calore, ad esempio quando metti una bottiglia di plastica nella lavastoviglie, i legami chimici che legano queste molecole di BPA insieme possono rompersi in un processo noto come idrolisi. A causa della sua struttura unica, i policarbonati BPA sono generalmente più suscettibili all'idrolisi rispetto alla plastica come il polietilene.
L'idrolisi scompone la plastica a livello chimico e questo rilascia una piccola quantità di molecole di BPA nell'ambiente. In uno studio, i ricercatori hanno scoperto che il processo di lavaggio di una bottiglia di policarbonato percolava da 0,2 a 0,3 milligrammi di BPA in ogni litro d'acqua. Per il contesto, questo è centinaia di volte meno concentrato dei livelli di calcio e sodio nell'acqua potabile.
La ricerca di un sostituto del BPA
Il BPA è un distruttore endocrino, il che significa che interrompe il funzionamento degli ormoni nel corpo. Dati gli effetti negativi sulla salute del consumo di BPA e il fatto che si rompe se esposto all'acqua, i chimici hanno cercato per anni dei sostituti.
Una delle principali preoccupazioni nella progettazione di nuove plastiche è che sostituire il BPA con un'altra molecola potrebbe non eliminare gli effetti negativi sulla salute. Proprio come la struttura chimica del BPA determina le proprietà del materiale, la struttura è anche ciò che innesca gli effetti biologici negativi. Gli interferenti endocrini come il BPA, a causa delle loro strutture simili agli ormoni naturali, possono legarsi e attivare i recettori endocrini.
La ricerca ha dimostrato che sostituti chimici strutturalmente simili, come il bisfenolo F, producono effetti sulla salute simili al BPA.
Inoltre, non è facile scambiare una nuova molecola che abbia una struttura chimica diversa perché la plastica perderà le caratteristiche desiderabili dei policarbonati BPA. Ma ci sono alcune nuove promettenti ricerche. Un percorso di ricerca si concentra sulla produzione di policarbonati facendo reagire molecole rigide a base biologica con anidride carbonica.
I policarbonati sono una parte onnipresente della vita moderna. Man mano che i ricercatori sviluppano nuovi materiali, è importante considerare non solo i rischi per la salute, come sta facendo l'EPA con il BPA, ma anche gli effetti ambientali. + Esplora ulteriormente
Questo articolo è stato ripubblicato da The Conversation con licenza Creative Commons. Leggi l'articolo originale. 