Astratto grafico. Credito:Rivista della American Chemical Society (2022). DOI:10.1021/jacs.1c12407
I ricercatori dell'Università dell'East Anglia hanno identificato una nuova classe di enzimi coinvolti nella gestione dello stress nei batteri.
Tutti gli organismi, dall'uomo ai batteri, devono essere in grado di rispondere a un'ampia gamma di stress derivanti dai cambiamenti nel loro ambiente.
Tra questi comuni sono i cosiddetti stress ossidativi e nitrosativi, che si verificano quando un organismo è esposto rispettivamente ad alte concentrazioni di ossigeno di reazione o di specie reattive dell'azoto. Quando ciò accade, i componenti fragili della cellula vengono danneggiati, portando alla perdita di funzione e, in alcuni casi, alla morte cellulare.
Non sorprende che gli organismi abbiano sviluppato una moltitudine di sistemi di risposta allo stress che rilevano e alleviano particolari stress.
I cluster ferro-zolfo, che consistono in ferro e zolfo inorganico, si trovano in tutti i tipi cellulari dove svolgono ruoli essenziali in un'ampia gamma di processi cellulari. Poiché sono così reattivi, sono spesso i primi componenti cellulari a subire danni in condizioni di stress.
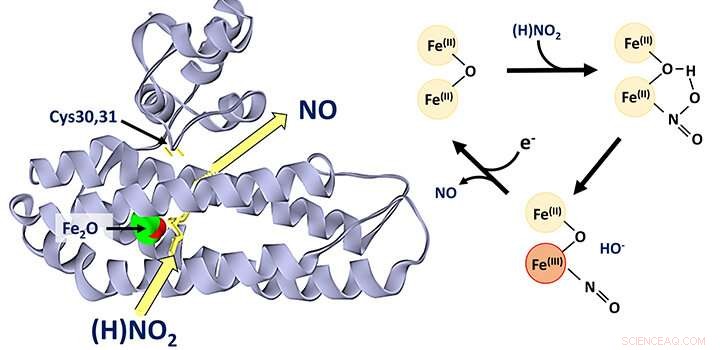
Si ritiene generalmente che la proteina di-ferro YtfE, che si trova ampiamente nei batteri, funzioni direttamente nella riparazione dei cluster ferro-zolfo che sono stati danneggiati in condizioni di stress. Questa attività è stata variamente proposta per comportare la donazione di ferro per la ricostruzione di cluster ferro-zolfo o la rimozione dell'ossido nitrico (NO) da cluster danneggiati.
Recentemente sono emerse nuove prove da studi sulla funzione di YtfE nelle cellule che hanno suggerito che la sua attività è associata ad un aumento, e non ad una diminuzione, della concentrazione di NO. Ciò ha spinto i ricercatori della School of Chemistry a riesaminare la funzione di YtfE.
Il team, guidato dal Dr. Jason Crack e dal Prof Nick Le Brun, e coinvolgendo il laboratorio del Dr. Fraser MacMillan, così come i ricercatori dell'Università di Birmingham e dell'Università di Sheffield, hanno scoperto che YtfE è un nuovo tipo di enzima nitrito reduttasi che produce NO.
Hanno dimostrato che YtfE non rimuove efficacemente l'NO dai cluster ferro-zolfo danneggiati, né è un donatore efficace di ferro per l'assemblaggio dei cluster.
La produzione catalizzata da YtfE di NO tossico da nitrito (NO2 - ) può sembrare strano, ma YtfE è co-regolato con un altro enzima, chiamato Hcp, che funziona per disintossicare l'NO (attraverso la sua riduzione a protossido di azoto, N2 O).
La via di disintossicazione accoppiata YtfE/Hcp rappresenta un mezzo efficace attraverso il quale la cellula affronta i livelli tossici di nitrito che possono verificarsi in condizioni anaerobiche.
Il team ha utilizzato una serie di approcci, tra cui la spettroscopia proteica genetica e in vitro e la spettrometria di massa, per ottenere informazioni dettagliate sul meccanismo mediante il quale YtfE genera NO dal nitrito.
Il lavoro chiarisce il ruolo di una proteina che da molto tempo lascia perplessi i ricercatori, dimostrando che YtfE è un attore chiave per la gestione dello stress in condizioni di respirazione anaerobica, come quelle che si trovano nell'intestino umano o quando si infetta un ospite umano.
Il lavoro è stato pubblicato questa settimana nel Journal of the American Chemical Society . + Esplora ulteriormente