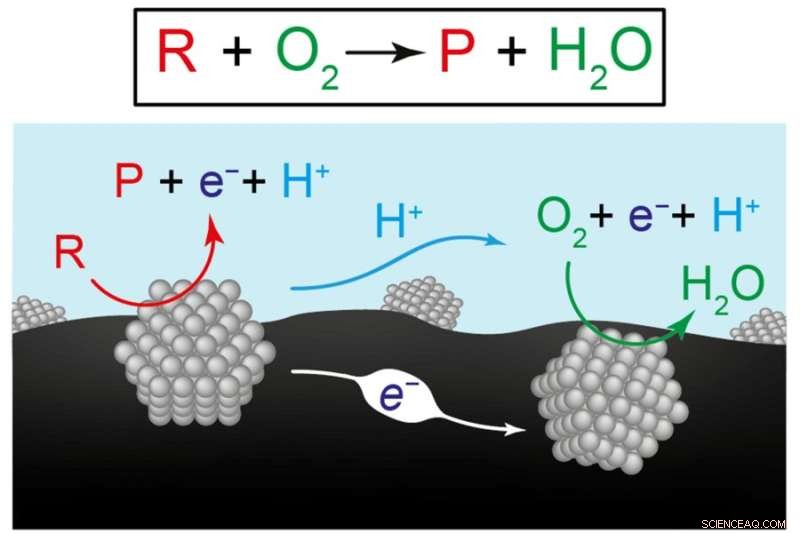
Questa figura presenta due viste delle reazioni chimiche per la produzione di combustibili e sostanze chimiche rinnovabili. L'equazione in alto rappresenta la conversione del reagente (R) più ossigeno (O2) in un prodotto (P) più acqua (H2O). Il diagramma seguente illustra l'ipotesi dei ricercatori secondo cui la reazione complessiva è il risultato di due semireazioni coordinate che si verificano su materiali catalizzatori separati, qui rappresentati da strutture grigie. Sul catalizzatore di sinistra, il reagente si trasforma in un prodotto, inviando elettroni (e-) nel materiale di supporto del carbonio (nero) e protoni (H+) nell'acqua (blu). Sul catalizzatore di destra, elettroni e protoni vengono consumati mentre guidano la reazione dell'ossigeno all'acqua. Credito:Immagine per gentile concessione dei ricercatori.
Una sfida nella decarbonizzazione del sistema energetico è sapere come affrontare i nuovi tipi di combustibili. I combustibili tradizionali come il gas naturale e il petrolio possono essere combinati con altri materiali e quindi riscaldati a temperature elevate in modo che reagiscano chimicamente per produrre altri combustibili o sostanze utili, o anche energia per svolgere il lavoro. Ma i nuovi materiali come i biocarburanti non possono sopportare tanto calore senza rompersi.
Un ingrediente chiave in tali reazioni chimiche è un catalizzatore solido appositamente progettato che viene aggiunto per incoraggiare la reazione, ma non viene consumato nel processo. Con i materiali tradizionali, il catalizzatore solido interagisce tipicamente con un gas; ma con i combustibili derivati dalla biomassa, ad esempio, il catalizzatore deve funzionare con un liquido, una sfida speciale per chi progetta catalizzatori.
Per quasi un decennio Yogesh Surendranath, professore associato di chimica al MIT, si è concentrato sulle reazioni chimiche tra catalizzatori solidi e liquidi, ma in una situazione diversa:invece di usare il calore per guidare le reazioni, lui e il suo team immettono elettricità da un batteria o una fonte rinnovabile come l'eolico o il solare per fornire più energia alle molecole chimicamente inattive in modo che reagiscano. E la chiave della loro ricerca è la progettazione e la fabbricazione di catalizzatori solidi che funzionano bene per reazioni che coinvolgono liquidi.
Riconoscendo la necessità di utilizzare la biomassa per sviluppare combustibili liquidi sostenibili, Surendranath si è chiesto se lui e il suo team potessero prendere i principi che hanno appreso sulla progettazione di catalizzatori per guidare le reazioni liquido-solido con l'elettricità e applicarli alle reazioni che si verificano alle interfacce liquido-solido senza qualsiasi input di energia elettrica.
Con loro sorpresa, hanno scoperto che la loro conoscenza è direttamente rilevante. Come mai? "Quello che abbiamo scoperto, sorprendentemente, è che anche quando non colleghi i cavi al catalizzatore, ci sono minuscoli 'cavi' interni che fanno la reazione", afferma Surendranath. "Quindi, le reazioni che le persone generalmente pensano operino senza alcun flusso di corrente in realtà coinvolgono gli elettroni che si spostano da un luogo all'altro". Ciò significa che Surendranath e il suo team possono utilizzare le potenti tecniche dell'elettrochimica per affrontare il problema della progettazione di catalizzatori per combustibili sostenibili.
Una nuova ipotesi
Il loro lavoro si è concentrato su una classe di reazioni chimiche importanti nella transizione energetica che implicano l'aggiunta di ossigeno a piccole molecole organiche (contenenti carbonio) come etanolo, metanolo e acido formico. L'ipotesi convenzionale è che il reagente e l'ossigeno reagiscano chimicamente per formare il prodotto più acqua. E un catalizzatore solido, spesso una combinazione di metalli, è presente per fornire siti su cui il reagente e l'ossigeno possono interagire.
Ma Surendranath ha proposto una visione diversa di quello che sta succedendo. Nella configurazione abituale, due catalizzatori, ciascuno composto da molte nanoparticelle, sono montati su un substrato di carbonio conduttivo e immersi in acqua. In tale disposizione, gli elettroni con carica negativa possono fluire facilmente attraverso il carbonio, mentre i protoni con carica positiva possono fluire facilmente attraverso l'acqua.
L'ipotesi di Surendranath era che la conversione del reagente in prodotto procedesse per mezzo di due "mezze reazioni" separate sui due catalizzatori. Su un catalizzatore, il reagente si trasforma in un prodotto, inviando nel processo elettroni nel substrato di carbonio e protoni nell'acqua. Questi elettroni e protoni vengono catturati dall'altro catalizzatore, dove guidano la conversione ossigeno-acqua. Quindi, invece di una singola reazione, due semireazioni separate ma coordinate insieme ottengono la conversione netta del reagente in prodotto.
Di conseguenza, la reazione complessiva in realtà non comporta alcuna produzione o consumo netto di elettroni. È una reazione "termica" standard risultante dall'energia nelle molecole e forse da un po' di calore aggiunto. L'approccio convenzionale alla progettazione di un catalizzatore per tale reazione si concentrerebbe sull'aumento della velocità di conversione da reagente a prodotto. E il miglior catalizzatore per questo tipo di reazione potrebbe essere, per esempio, oro o palladio o qualche altro metallo prezioso costoso.
Tuttavia, se quella reazione coinvolge effettivamente due semireazioni, come proposto da Surendranath, c'è un flusso di carica elettrica (gli elettroni e i protoni) tra di loro. Quindi Surendranath e altri nel campo potrebbero invece utilizzare tecniche di elettrochimica per progettare non un singolo catalizzatore per la reazione complessiva, ma piuttosto due catalizzatori separati, uno per accelerare una semireazione e uno per accelerare l'altra semireazione. "Ciò significa che non dobbiamo progettare un catalizzatore per fare tutto il lavoro pesante per accelerare l'intera reazione", afferma Surendranath. "Potremmo essere in grado di accoppiare due catalizzatori a basso costo, abbondanti in terra, ognuno dei quali fa bene metà della reazione, e insieme eseguono la trasformazione complessiva in modo rapido ed efficiente."
Ma c'è un'altra considerazione:gli elettroni possono fluire attraverso l'intero catalizzatore composito, che comprende le particelle di catalizzatore e il substrato di carbonio. Affinché la conversione chimica avvenga il più rapidamente possibile, la velocità con cui gli elettroni vengono inseriti nel composito catalizzatore deve corrispondere esattamente alla velocità con cui vengono estratti. Concentrandosi solo sugli elettroni, se la conversione da reazione a prodotto sul primo catalizzatore invia lo stesso numero di elettroni al secondo nel "bagno di elettroni" nel composito catalizzatore come richiede la conversione ossigeno-acqua sul secondo catalizzatore fuori, le due semireazioni saranno bilanciate e il flusso di elettroni, e la velocità della reazione combinata, saranno veloci. Il trucco è trovare buoni catalizzatori per ciascuna delle semireazioni che siano perfettamente abbinate in termini di elettroni in entrata e in uscita.
"Un buon catalizzatore o una coppia di catalizzatori può mantenere un potenziale elettrico, essenzialmente una tensione, al quale entrambe le semireazioni sono veloci e bilanciate", afferma Jaeyune Ryu Ph.D. '21, un ex membro del laboratorio Surendranath e autore principale dello studio; Ryu è ora un post-dottorato all'Università di Harvard. "Le velocità delle reazioni sono uguali e la tensione nel composito catalizzatore non cambierà durante la reazione termica complessiva."
Disegno sull'elettrochimica
Sulla base della loro nuova comprensione, Surendranath, Ryu e i loro colleghi si sono rivolti alle tecniche di elettrochimica per identificare un buon catalizzatore per ogni semireazione che si sarebbe anche accoppiato per funzionare bene insieme. La loro struttura analitica per guidare lo sviluppo di catalizzatori per sistemi che combinano due semireazioni si basa su una teoria che è stata utilizzata per comprendere la corrosione per quasi 100 anni, ma raramente è stata applicata per comprendere o progettare catalizzatori per reazioni che coinvolgono piccole molecole importanti per il transizione energetica.
Key to their work is a potentiostat, a type of voltmeter that can either passively measure the voltage of a system or actively change the voltage to cause a reaction to occur. In their experiments, Surendranath and his team use the potentiostat to measure the voltage of the catalyst in real time, monitoring how it changes millisecond to millisecond. They then correlate those voltage measurements with simultaneous but separate measurements of the overall rate of catalysis to understand the reaction pathway.
For their study of the conversion of small, energy-related molecules, they first tested a series of catalysts to find good ones for each half-reaction—one to convert the reactant to product, producing electrons and protons, and another to convert the oxygen to water, consuming electrons and protons. In each case, a promising candidate would yield a rapid reaction—that is, a fast flow of electrons and protons out or in.
To help identify an effective catalyst for performing the first half-reaction, the researchers used their potentiostat to input carefully controlled voltages and measured the resulting current that flowed through the catalyst. A good catalyst will generate lots of current for little applied voltage; a poor catalyst will require high applied voltage to get the same amount of current. The team then followed the same procedure to identify a good catalyst for the second half-reaction.
To expedite the overall reaction, the researchers needed to find two catalysts that matched well—where the amount of current at a given applied voltage was high for each of them, ensuring that as one produced a rapid flow of electrons and protons, the other one consumed them at the same rate.
To test promising pairs, the researchers used the potentiostat to measure the voltage of the catalyst composite during net catalysis—not changing the voltage as before, but now just measuring it from tiny samples. In each test, the voltage will naturally settle at a certain level, and the goal is for that to happen when the rate of both reactions is high.
Validating their hypothesis and looking ahead
By testing the two half-reactions, the researchers could measure how the reaction rate for each one varied with changes in the applied voltage. From those measurements, they could predict the voltage at which the full reaction would proceed fastest. Measurements of the full reaction matched their predictions, supporting their hypothesis.
The team's novel approach of using electrochemistry techniques to examine reactions thought to be strictly thermal in nature provides new insights into the detailed steps by which those reactions occur and therefore into how to design catalysts to speed them up. "We can now use a divide-and-conquer strategy," says Ryu. "We know that the net thermal reaction in our study happens through two 'hidden' but coupled half-reactions, so we can aim to optimize one half-reaction at a time"—possibly using low-cost catalyst materials for one or both.
Adds Surendranath, "One of the things that we're excited about in this study is that the result is not final in and of itself. It has really seeded a brand-new thrust area in our research program, including new ways to design catalysts for the production and transformation of renewable fuels and chemicals." + Esplora ulteriormente
Questa storia è stata ripubblicata per gentile concessione di MIT News (web.mit.edu/newsoffice/), un popolare sito che copre notizie sulla ricerca, l'innovazione e l'insegnamento del MIT.