Un numero crescente di batteri è diventato resistente a molti antibiotici comunemente usati. I ricercatori di Bochum hanno scoperto una nuova opportunità per una potenziale molecola attiva il cui predecessore era stato rifiutato. Studiando la sua interazione con la proteina bersaglio batterica in modo molto preciso in tre dimensioni, hanno identificato un punto di attacco precedentemente non rilevato che potrebbe essere preso di mira da questo composto.
"Poiché questo punto di attacco si verifica solo nelle proteine batteriche, il farmaco diventerebbe molto più selettivo e la sua nocività per le cellule umane sarebbe ridotta", spiega il professor Raphael Stoll, capo del gruppo di ricerca sulla spettroscopia NMR biomolecolare presso la Facoltà di chimica e biochimica presso l'Università della Ruhr a Bochum, in Germania.
I ricercatori hanno pubblicato i loro risultati il 4 aprile 2024 sul Journal of Medicinal Chemistry .
Lo studio si è concentrato sulla proteina peptide deformilasi (PDF). Coinvolto nei processi di maturazione delle proteine nelle cellule, il PDF è essenziale per la sopravvivenza dei batteri. Tuttavia, si trova sia nei batteri che nelle cellule umane. "Circa 20 anni fa furono fatti tentativi significativi per combattere la PDF con agenti antibiotici", sottolinea Stoll.
"Tuttavia, il farmaco candidato originale, l'actinonina, ha dovuto essere scartato per diversi motivi. Uno dei problemi affrontati è stato il PDF umano recentemente scoperto, che era potenzialmente associato a effetti collaterali. Tuttavia, sono state condotte ulteriori ricerche per generare composti attivi modificati ," aggiunge Hendrik Kirschner.
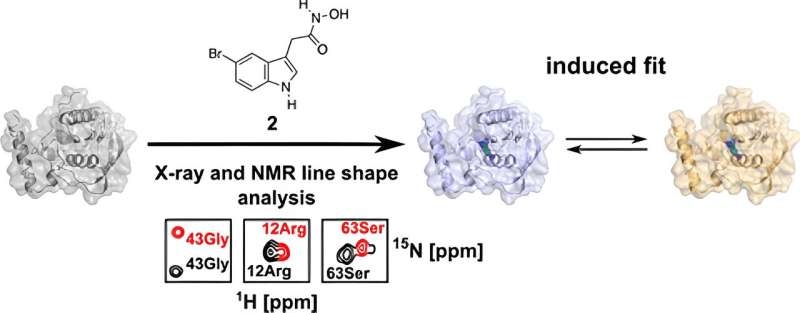
Nell'ambito della sua tesi di dottorato, ha esaminato in dettaglio il PDF nel presente studio e lo ha analizzato dal punto di vista della biologia strutturale utilizzando la spettroscopia di risonanza magnetica nucleare biomolecolare (NMR) e la cristallografia a raggi X. Queste tecniche gli hanno permesso di ottenere una struttura 3D risolta nei minimi dettagli.
"Questo è il risultato di molti anni di collaborazione con il nostro collega, il professor Eckhard Hofmann", afferma Stoll.
"Possiamo utilizzare queste tecniche per visualizzare le superfici e le tasche di legame delle biomolecole e dimostrare che il legame della molecola a questa proteina non è statico, ma dinamico", spiega Kirschner.
I ricercatori hanno notato che ci sono due diversi orientamenti di legame nella proteina per una molecola di farmaco modificata:oltre all'orientamento presente anche nella PDF umana, ce n'è un altro che, in linea di principio, dovrebbe verificarsi esclusivamente nella PDF batterica.
"Questo ci spinge a modificare la molecola del farmaco in modo che favorisca il secondo orientamento di legame", afferma Stoll.
Di conseguenza, la molecola antibiotica potrebbe essere resa più selettiva. "Potrebbe fornire a questo farmaco candidato una seconda possibilità", conclude Kirschner.
Ulteriori informazioni: Hendrik Kirschner et al, Toward More Selective Antibiotic Inhibitors:A Structural View of the Complexed Binding Pocket of E. coli Peptide Deformylase, Journal of Medicinal Chemistry (2024). DOI:10.1021/acs.jmedchem.3c02382
Informazioni sul giornale: Giornale di chimica medicinale
Fornito da Ruhr-Universitaet-Bochum