Il virus Lassa (LASV) è l’agente patogeno che causa la febbre emorragica di Lassa, una malattia endemica dell’Africa occidentale, che provoca circa 5.000 decessi ogni anno. Presso il Centro CSSB per la biologia dei sistemi strutturali, i gruppi di Uetrecht (CSSB, LIV, Uni Siegen), Kosinski (CSSB, EMBL) e Rosenthal (BNITM, CSSB) hanno lavorato insieme per rivelare il ruolo cruciale svolto dall'RNA nelle fasi critiche del processo di Lassa ciclo di vita del virus.
I loro risultati sono pubblicati nel Journal of American Chemical Society .
Nel corpo umano, 20.000 geni producono oltre un milione di forme diverse di proteine. Il virus Lassa in confronto è minuscolo poiché è composto da sole quattro proteine, note come L, NP, Z e GPC.
"Stiamo cercando di capire come queste quattro proteine possano causare danni così gravi alle cellule umane", spiega il primo autore dello studio Lennart Sänger. "Le attività e l'espressione di queste proteine devono essere strettamente regolate e le proteine devono comunicare in modo efficiente tra loro per assumere funzioni diverse."
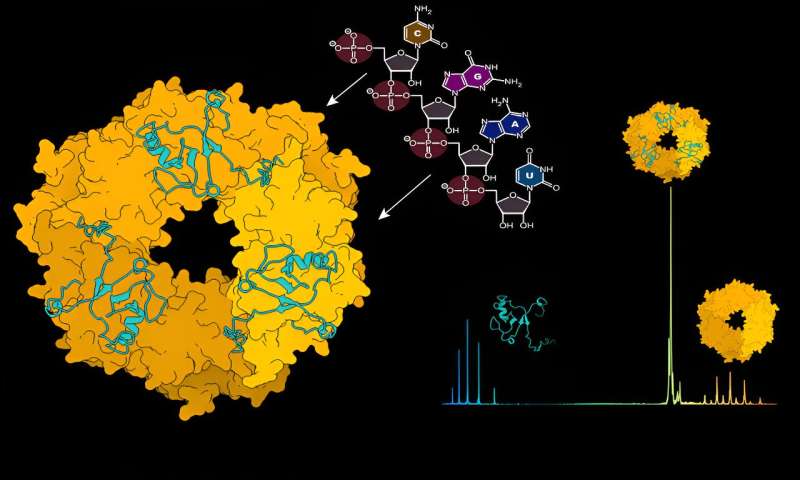
Per proteggere e nascondere il virus dal rilevamento da parte del sistema immunitario, la nucleoproteina (NP) racchiude il genoma virale in un capside. Questo capside insieme all'RNA virale e alla proteina L forma complessi ribonucleoproteici (RNP).
Per propagare l’infezione, gli RNP devono ristrutturarsi continuamente per consentire la replicazione e la trascrizione del genoma virale. I ricercatori hanno studiato le interazioni tra NP e RNA virale, nonché la proteina Z, per comprendere meglio il meccanismo e le dinamiche della formazione e del confezionamento dell'RNP in nuove particelle virali.
Utilizzando la spettrometria di massa strutturale, un metodo che agisce come una scala molecolare rivelando il peso atomico delle interazioni molecolari, i ricercatori hanno esaminato la dinamica tra NP e RNA virale. "Inizialmente, la proteina NP non esiste in una composizione in grado di legare l'RNA virale", spiega Charlotte Uetrecht, leader del gruppo CSSB ed esperta in tecniche di spettrometria di massa.
"È necessario che si verifichi un cambiamento per consentire questo legame e abbiamo scoperto che l'RNA virale può avviare questo cambiamento da solo." I ricercatori hanno identificato l'RNA come il motore del disassemblaggio dei trimeri NP ad anello in monomeri che sono quindi in grado di formare assemblaggi NP legati all'RNA di ordine superiore.
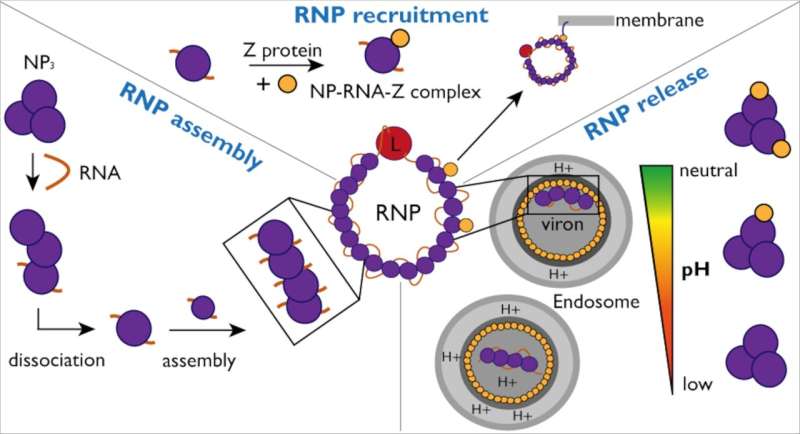
I ricercatori hanno inoltre studiato più dettagliatamente l'interazione delle NP con la proteina Z. Per facilitare ciò, il gruppo Kosinski ha utilizzato AlphaFold per prevedere il sito di interazione del complesso NP-Z. Queste previsioni sono state poi verificate dai ricercatori in laboratorio.
"L'uso dell'intelligenza artificiale ci ha permesso di identificare rapidamente possibili interazioni e ci ha anche permesso di creare mutanti per verificare la nostra ipotesi", osserva Jan Kosinski. Alla fine i ricercatori sono riusciti a dimostrare che mentre NP lega Z indipendentemente dalla presenza di RNA, questa interazione dipende dal pH.
"Nel complesso, questi risultati aiutano a migliorare la nostra comprensione dell'assemblaggio, del reclutamento e del rilascio degli RNP nel virus Lassa", spiega Maria Rosenthal, esperta di virus Lassa presso l'Istituto Bernhard Nocht per la medicina tropicale e membro associato della CSSB. Nell'Africa occidentale, si prevede che 186 milioni di persone saranno a rischio di infezione da virus Lassa entro il 2030 e l'Organizzazione Mondiale della Sanità riconosce il virus Lassa come un agente patogeno pericoloso e ancora poco studiato.
"Capire come funziona il virus Lassa potrebbe in definitiva consentirci di sviluppare molecole che potrebbero inibire la replicazione di questo virus e curare la febbre di Lassa", osserva Rosenthal.
Ulteriori informazioni: Lennart Sänger et al, RNA to Rule Them All:passaggi critici nell'assemblaggio e nel reclutamento delle ribonucleoparticelle del virus Lassa, Journal of the American Chemical Society (2023). DOI:10.1021/jacs.3c07325
Informazioni sul giornale: Giornale dell'American Chemical Society
Fornito dal Centro CSSB per la biologia dei sistemi strutturali